Бактериальный ожог плодовых культур (Erwinia amylovora)
Бактериаальный ожог плодовых культур — опасное инфекционное заболевание культурных и дикорастущих растений семейства розоцветных, вызываемое бактерией Erwinia amylovora. Родиной возбудителя считается Северная Америка, откуда он широко распространился по всему миру. Проникновение в Европу датируется серединой 1950-х годов. В Англии заболевание впервые отмечено на грушах в графстве Кент в 1957 году. На континенте — в Польше на грушевых деревьях в 1966 году. В 2005 году очаги поражения бактериальным ожогом отмечались в большинстве стран Европейского Союза — от Кипра на юге, до Швеции на севере, а также вне Евросоюза (Армения, Египет, Израиль, Иордания, Ливан, Норвегия, Швейцария, Турция, Украина). В Белоруссии впервые выявлено в 2008 году.
В России до недавнего времени заболевание отсутствовало, но, согласно данным Всероссийского центра карантина растений, к 2009 году очаги бактериального ожога выявлены в Калининградской, Самарской, Воронежской, Белгородской и Тамбовской областях, а также в Карачаево-Черкесии.
В Волгоградской области бактериальный ожог плодовых выявлен в 2010 г. на территории г. Краснослободск Среднеахтубинского района.
Заболевание поражает растения из семейства розоцветных, внедряясь в цветок. После развивается характерный некроз («ожог»), идущий от остатков цветения по ветви к стволу. В условиях Волгоградской области отмечены поражения айвы и боярышника. Также возможно поражение яблони, груши, кизильника, ирги, рябины и других розоцветных. Поражение молодых, еще не цветущих растений менее вероятны, но возможны через раневые поверхности. Распространяется с посадочным и прививочным материалом, а в пределах садов – с насекомыми и птицами.
Карантинные фитосанитарные меры: Определены в руководстве «Методические рекомендации по проведению карантинных фитосанитарных мероприятий в очаге возбудителя бактериального ожога плодовых культур, ФГБУ ВНИИКР, 2008»:
1.
 Два раза в год обследуются питомники и хозяйства, в которые поступает импортный посадочный материал на отсутствие возбудителя ожога;
Два раза в год обследуются питомники и хозяйства, в которые поступает импортный посадочный материал на отсутствие возбудителя ожога;2. Ежегодно обследуются все иные насаждения растений-хозяев на отсутствие возбудителя ожога;
3. Зараженные деревья подлежат выкорчевке и сжиганию, также как и все соседние растения-хозяева в радиусе 10-20 м;
4. С территории очага и на его территорию запрещен вывоз и ввоз, а также реализация саженцев, привоев и подвоев;
5. Запрещено использование сельскохозяйственной техники, транспортных средств, инструментов для обрезки, которыми пользовались на территории очага в текущем сезоне, на других участках до их полной дезинфекции;
7. На территории очага в садах проводят пятикратное опрыскивание по цветущим плодовым деревьям бордосской жидкостью или другим медьсодержащим препаратом, разрешенным к применению, также проводят профилактические обработки инсектицидами против сосущих насекомых;
8.
 Вывоз растений-хозяев в любой форме из КФЗ разрешен только при прохождении установления фитосанитарного состояния и наличии карантинного фитосанитарного сертификата.
Вывоз растений-хозяев в любой форме из КФЗ разрешен только при прохождении установления фитосанитарного состояния и наличии карантинного фитосанитарного сертификата.Erwinia amylovora (ERWIAM)[Overview]| EPPO Global Database
Overview
Code created in: 2002-11-09
Basic information
- EPPO Code: ERWIAM
- Preferred name: Erwinia amylovora
- Authority: (Burrill) Winslow, Broadhurst, Buchanan, Krumwiede, Rogers & Smith
Notes
One of the «top ten» bacteria in molecular plant pathology
Other scientific names
| Name | Authority |
|---|---|
| Bacillus amylovorus | (Burrill) Trevisan |
| Bacterium amylovorum | (Burrill) Chester |
Erwinia amylovora f. sp. rubi sp. rubi |
Starr, Cardona & Folsom |
| Micrococcus amylovorus | Burrill |
Common names
| Name | Language |
|---|---|
| fire blight | English (US) |
| fireblight | English (GB) |
| twig blight of apple | English |
| Apfelbrand | German |
| Bakterienfeuerbrand | German |
| Birnenbrand | German |
| Feuerbrand: Obstgehölze | German |
| brûlure bactérienne du poirier | French |
| brûlure bactérienne du pommier | French |
| feu bactérien | French |
| fuego bacteriano | Spanish |
| marchitez del manzano | Spanish |
| marchitez del peral | Spanish |
| niebla del manzano | Spanish |
| niebla del peral | Spanish |
| tizón de fuego del manzano | Spanish (MX) |
| tizón de fuego del peral | Spanish (MX) |
| colpo di fuoco | Italian |
| bakterievuur | Dutch |
| fogo-bacteriano | Portuguese |
| päronpest | Swedish |
| бактериальный ожог плодовых культур | Russian |
| Бактериальный ожог плодовых культур | Russian |
| ildsot | Danish |
| pærebraun | Norwegian |
| ateş yanıklığı | Turkish |
| kerakhon | Hebrew |
| zaraza ogniowa | Polish |
| tűzelhalás | Hungarian |
| الحارقةاللفحة | Arabic |
more photos. ..
..
Taxonomy
Kingdom Bacteria ( 1BACTK )
Phylum Proteobacteria ( 1PROBP )
Class Gammaproteobacteria ( 1GAMBC )
Order Enterobacterales ( 1ENTEO )
Family Erwiniaceae ( 1ERWIF )
Genus Erwinia ( 1ERWIG )
Species Erwinia amylovora ( ERWIAM )
Бактериальный ожог яблони и груши
Джонсон, К.Б. 2000. Бактериальный ожог яблони и груши. Инструктор по здоровью растений . DOI: 10.1094/PHI-I-2000-0726-01
Обновлено в 2015 г.
БОЛЕЗНЬ: бактериальный ожог яблони и груши
Возбудитель: Erwinia amylovora
ХОЗЯИНЫ: яблоня, груша, несколько розоцветных декоративных растений
Автор
Кеннет Б. Джонсон,
Джонсон,
Университет штата Орегон
Erwinia amylovora является местным патогеном диких розоцветных хозяев в восточной части Северной Америки. Это была первая бактерия, которая оказалась патогенной для растений. Сегодня бактериальный ожог является серьезной болезнью яблонь и груш во многих частях мира.
Побеги груши с бактериальным ожогом. (Предоставлено К. Джонсон)
Симптомы и признаки
Симптомы бактериального ожога можно наблюдать на всех надземных тканях, включая цветки, плоды, побеги, ветки и ветки, а также на подвое возле места прививки на нижней части ствола. Как правило, симптомы бактериального ожога легко распознать и отличить от других заболеваний.
Соцветия и молодые побеги
Первые признаки цветения наблюдаются через 1-2 недели после опадения лепестков. Цветоложе, завязь и цветоносы становятся водянистыми и тусклыми, приобретают серовато-зеленый вид. Позже эти ткани сморщиваются и становятся коричневыми до черных. Подобные симптомы часто развиваются в основании соцветия и молодых плодах по мере внутреннего распространения инфекции (рис. 2). В периоды высокой влажности на пропитанных водой и обесцвеченных тканях образуются маленькие капли бактериального ила (см. пример на фруктах, рис. 7). Капли слизи изначально кремово-белые, с возрастом приобретают янтарный оттенок.
Позже эти ткани сморщиваются и становятся коричневыми до черных. Подобные симптомы часто развиваются в основании соцветия и молодых плодах по мере внутреннего распространения инфекции (рис. 2). В периоды высокой влажности на пропитанных водой и обесцвеченных тканях образуются маленькие капли бактериального ила (см. пример на фруктах, рис. 7). Капли слизи изначально кремово-белые, с возрастом приобретают янтарный оттенок.
| Рисунок 2 | Рисунок 7 |
Симптомы на побегах
Симптомы на побегах аналогичны симптомам на цветках, но развиваются быстрее. Кончики побегов могут быстро увядать, образуя «пастуший посох» (рис. 1 и 3). Листья на больных побегах часто имеют почернение вдоль средней жилки и жилок, прежде чем они полностью некротизируются. Многочисленные больные побеги придают дереву обгоревший, пораженный болезнью вид, отсюда и название болезни (рис. 4).
Многочисленные больные побеги придают дереву обгоревший, пораженный болезнью вид, отсюда и название болезни (рис. 4).
| | Рисунок 3 | Рисунок 4 |
Проявленные лиственные симптомы
Инфекция, начавшаяся в цветках и побегах, может продолжать распространяться как вверх, так и вниз по более крупным ветвям и ветвям. Кора на более молодых ветвях темнеет и становится водянистой (рис. 5). На поздних стадиях в коре образуются трещины, а поверхность немного впадает (рис. 6). На коре может присутствовать бактериальный ил янтарного цвета, смешанный с соком растений. На древесине под корой видны прожилки от коричневого до черного цвета.
| Рисунок 5 | Рисунок 6 |
Плоды груши и яблони
На поверхности незрелых плодов образуются водянистые пятна индетерминантной формы, которые позже становятся коричневыми или черными. Капли бактериального сока могут образовываться на очагах поражения, обычно в сочетании с чечевичками (рис. 7). Сильно больные плоды полностью чернеют и сморщиваются.
Подвои яблони
Инфекции подвоя обычно развиваются вблизи места прививки в результате внутреннего перемещения патогена по дереву или в результате заражения через водяные побеги или заусенцы. Кора зараженных подвоев может пропитываться водой, изменять цвет от пурпурного до черного, растрескиваться и иметь признаки бактериального сока. На древесине непосредственно под корой могут быть видны полосы от красно-коричневых до черных (рис. 8). Симптомы гнили подвоя можно спутать с гнилью шейки фитофтороза. М.26 и М.9подвои очень восприимчивы к патогену.
8). Симптомы гнили подвоя можно спутать с гнилью шейки фитофтороза. М.26 и М.9подвои очень восприимчивы к патогену.
| Рисунок 8 |
Биология патогенов
Erwinia amylovora является членом семейства Enterobacteriacae. Клетки E. amylovora являются грамотрицательными, имеют палочковидную форму, размеры 0,5–1,0 х 3,0 мм, жгутиковые со всех сторон (перитрихозы) (рис. 9). Физиологически, E. amylovora классифицируется как факультативный анаэроб. Он растет на большинстве стандартных микробиологических сред и на некоторых дифференциальных средах. Оптимальная температура для роста составляет 27°C (81°F), а деление клеток происходит при температуре от 5 до 31°C (от 41 до 88°F). Идентификация
Изоляты E. amylovora основаны на биохимических тестах, инокуляции незрелых плодов груши и сеянцев яблони, секвенировании гена рибосомной РНК 16S и использовании видоспецифичных праймеров для ПЦР.
| Рисунок 9 | Рисунок 10 |
Эпифитная и эндофитная биология
На цветках, E. amylovora является прекрасным колонизатором поверхности рылец и, в меньшей степени, поверхности нектарника. Это размножение на цветочных поверхностях называется эпифитным ростом и происходит без бактерий, вызывающих заболевание. Эпифитный рост E. amylovora на рыльцах в сочетании с перемещением патогена от цветка к цветку насекомыми-опылителями (рис. 10) представляют собой два важных процесса, регулирующих частоту заражения цветков. Erwinia amylovora также может выживать на других здоровых поверхностях растений, таких как листья и ветки, в течение ограниченного периода времени (недели), но образования колоний и эпифитного роста на этих поверхностях не происходит.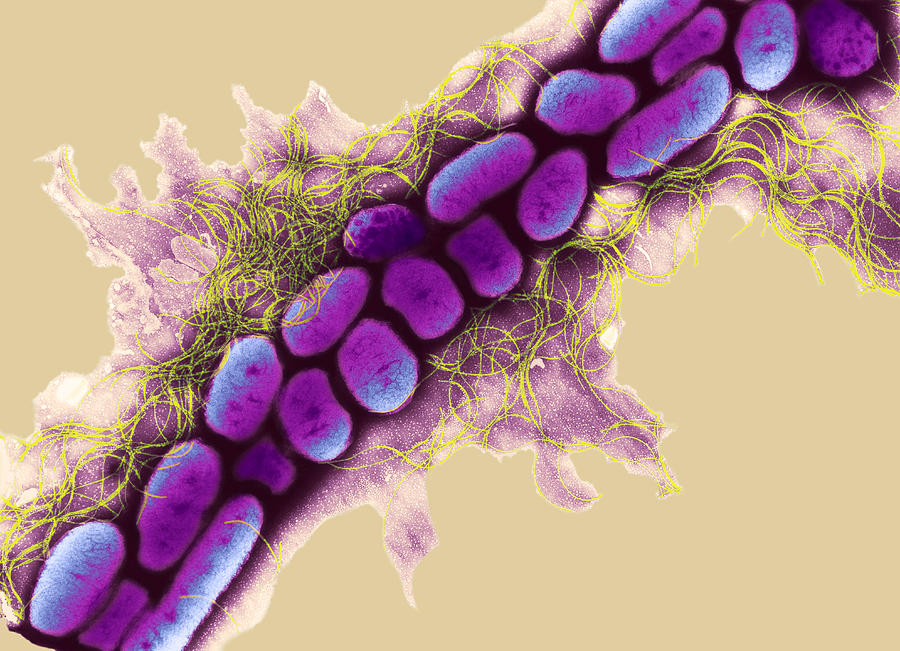 Клетки E. amylovora выделяют большое количество внеклеточного полисахарида (основной компонент бактериального ила), который создает матрицу, защищающую патоген на поверхности растений. В питомниках клетки E. amylovora , выживающая на древесных поверхностях, может вызывать заболевание, когда привои и подвои повреждаются во время прививки. Erwinia amylovora также может находиться в виде эндофита в внешне здоровых тканях растений, таких как ветви, конечности и почки. Миграция патогена через ксилему является одним из механизмов, с помощью которого цветочные инфекции яблони могут привести к заражению подвоя вблизи места прививки.
Клетки E. amylovora выделяют большое количество внеклеточного полисахарида (основной компонент бактериального ила), который создает матрицу, защищающую патоген на поверхности растений. В питомниках клетки E. amylovora , выживающая на древесных поверхностях, может вызывать заболевание, когда привои и подвои повреждаются во время прививки. Erwinia amylovora также может находиться в виде эндофита в внешне здоровых тканях растений, таких как ветви, конечности и почки. Миграция патогена через ксилему является одним из механизмов, с помощью которого цветочные инфекции яблони могут привести к заражению подвоя вблизи места прививки.
Цикл болезни и эпидемиология
Цикл болезни
Зимовка
Erwinia amylovora зимует в небольшом проценте однолетних язв, образовавшихся на ветвях, пораженных в предыдущем сезоне. Эти места зимовки называются «остаточными язвами». С повышением температуры весной возбудитель становится активным на краях остаточных язв. Свободные бактериальные клетки выделяются на поверхность коры, иногда в виде видимого ила. Насекомые, привлеченные илом (например, мухами) или дождем, распространяют бактерии из язвы на цветы.
С повышением температуры весной возбудитель становится активным на краях остаточных язв. Свободные бактериальные клетки выделяются на поверхность коры, иногда в виде видимого ила. Насекомые, привлеченные илом (например, мухами) или дождем, распространяют бактерии из язвы на цветы.
Цветочная эпифитная фаза
Рыльца на концах столбиков являются основным местом эпифитной колонизации и роста Е. амиловора . Во время цветочно-эпифитной фазы на конечную численность популяции, которую достигает возбудитель, влияет температура, которая регулирует время генерации возбудителя, и количество цветков, в которых возбудитель приживается, чему способствуют насекомые-опылители, медоносные пчелы. в частности. В идеальных условиях рыльца каждого цветка могут выдерживать ~10 6 клеток возбудителя.
Первичная инфекция цветков
Фитофтороз цветков возникает, когда клетки E. amylovora промывают снаружи от рыльца до гипантия (цветочная чашечка). На гипантии, E. amylovora проникает в растение через секреторные клетки (нектартоды), расположенные на поверхности. Для груши важность фитофтороза еще более возрастает из-за тенденции этого вида производить неприятные, вторичные или «хвостые» цветы в конце весны и в начале лета, спустя много времени после периода первичного цветения.
На гипантии, E. amylovora проникает в растение через секреторные клетки (нектартоды), расположенные на поверхности. Для груши важность фитофтороза еще более возрастает из-за тенденции этого вида производить неприятные, вторичные или «хвостые» цветы в конце весны и в начале лета, спустя много времени после периода первичного цветения.
Вторичные фазы
Включает пятнистость побегов, плодов и подвоя. Эти фазы обычно инициируются инокулятом, полученным на тканях, пораженных в результате заражения цветков. Раны обычно требуются E. amylovora для инициации гнили побегов и плодов. Насекомые, такие как щитовки и листоблошки, во время питания создают ранки на сочных побегах. Сильные ветры, дождь и град могут создавать многочисленные обширные раны в тканях хозяина. Случаи заражения, вызванные суровой погодой, иногда называют «травматическим ожогом». Подвои яблони могут быть вызваны поражением побегов водяных побегов или внутренней транслокацией E. amylovora от инфекций выше по дереву.
amylovora от инфекций выше по дереву.
Распространение язвы
Как первичные, так и вторичные инфекции могут распространяться в течение лета, при этом окончательная тяжесть инфекции зависит от вида хозяина, сорта, окружающей среды, возраста и состояния питания тканей хозяина. Молодые, сильные ткани и деревья более восприимчивы к бактериальному ожогу, чем старые, медленно растущие ткани или деревья. Точно так же деревья, получившие избыток азотных удобрений и, следовательно, быстро растущие, более восприимчивы, чем деревья, растущие в условиях сбалансированного режима питательных веществ. Скорость распространения язвы также может быть увеличена из-за высокого уровня воды в дереве, вызванного чрезмерным или частым орошением или плохо дренируемой почвой. Распространение язвы замедляется в конце лета по мере снижения температуры и снижения скорости роста деревьев и побегов.
Эпидемиологические модели
Фитофтороз спорадический от сезона к сезону из-за потребности в теплых температурах для развития крупных эпифитных популяций. Несколько эпидемиологических моделей (например, COUGARBLIGHT, MARYBLYT) предсказывают вероятность эпидемий цветкового ожога на основе наблюдаемых климатических условий (рис. 11). Модели работают, определяя периоды, благоприятные для эпифитного роста E. amylovora на цветках до того, как произойдет заражение, и, таким образом, широко используются для принятия решений о необходимости и сроках применения химикатов. Модели риска гниения цветков накапливают градусные единицы выше пороговой температуры 15,5 (60 ° F) или 18 ° C (64 ° F). Данные о дожде или влажности цветков в периоды теплой погоды также используются в моделях для более точного указания времени и вероятности заражения цветков. Другие основанные на температуре модели предсказывают время до проявления симптомов после инфицирования (т. е. продолжительность инкубационного периода) на основе суммы тепловых единиц. Эти модели используются для определения времени осмотра сада и/или обрезки.
Несколько эпидемиологических моделей (например, COUGARBLIGHT, MARYBLYT) предсказывают вероятность эпидемий цветкового ожога на основе наблюдаемых климатических условий (рис. 11). Модели работают, определяя периоды, благоприятные для эпифитного роста E. amylovora на цветках до того, как произойдет заражение, и, таким образом, широко используются для принятия решений о необходимости и сроках применения химикатов. Модели риска гниения цветков накапливают градусные единицы выше пороговой температуры 15,5 (60 ° F) или 18 ° C (64 ° F). Данные о дожде или влажности цветков в периоды теплой погоды также используются в моделях для более точного указания времени и вероятности заражения цветков. Другие основанные на температуре модели предсказывают время до проявления симптомов после инфицирования (т. е. продолжительность инкубационного периода) на основе суммы тепловых единиц. Эти модели используются для определения времени осмотра сада и/или обрезки.
| Рисунок 11 |
Борьба с болезнями
Эффективная борьба с бактериальным ожогом является многогранной и в основном профилактической. Садовод должен использовать комбинацию санитарии, агротехники и опрыскивания химическими или биологическими агентами, чтобы держать болезнь под контролем.
Садовод должен использовать комбинацию санитарии, агротехники и опрыскивания химическими или биологическими агентами, чтобы держать болезнь под контролем.
Сорта
Выбор устойчивого сорта является наиболее эффективным методом борьбы с бактериальным ожогом. У яблок, например, существуют сорта, умеренно устойчивые к болезни (например, Red и Golden Delicious). Для груш выбор сортов более ограничен, потому что превосходные садоводческие признаки (например, вкус, качество хранения и товарные качества) трудно сочетать с более высоким уровнем устойчивости к болезням. В последние годы бактериальный ожог стал более распространенным явлением на яблоках, потому что спектр сортов, выращиваемых в коммерческих целях, расширился и сместился в сторону сортов с большей восприимчивостью к болезни (например, Фуджи, Гала, Пинк Леди). С этим сдвигом пришло признание того, что популярные низкорослые подвои для яблони M.9и M.26, очень восприимчивы к Е. амиловора . Карликовые подвои с устойчивостью к бактериальному ожогу разрабатываются и коммерциализируются (например, серия женевских подвоев из Корнельского университета). Многие декоративные сорта также демонстрируют высокий уровень устойчивости к бактериальному ожогу.
Многие декоративные сорта также демонстрируют высокий уровень устойчивости к бактериальному ожогу.
Уничтожение перезимовавшего инокулята
Тщательная санитарная обработка посредством удаления расширяющихся и перезимовавших язв необходима для борьбы с бактериальным ожогом восприимчивых сортов. Удаление перезимовавших («остаточных») язв достигается путем осмотра и обрезки деревьев зимой.
Профилактика цветкового ожога
Профилактика заражения цветков важна при борьбе с бактериальным ожогом, потому что инфекции, возникающие в цветках, разрушительны, а клетки патогенов, происходящие от цветочных инфекций, обеспечивают большую часть инокулята для вторичных фаз болезни, включая заражение побеги, плоды и подвои. Мероприятия по борьбе с фитофторозом нацелены на эпифитную фазу цветения. Опрыскивание антибиотиками, стрептомицином, окситетрациклином или казугамицином эффективно подавляет инфекцию цветков в коммерческих садах (рис. 12).
| Рисунок 12 |
Соединения меди также эффективны, но их применение обычно ограничивается периодом перед цветением, поскольку ионы меди в растворе могут быть фитотоксичными для кожуры молодых плодов. E. amylovora стала устойчивой к стрептомицину в некоторых производственных зонах, что ограничивает эффективность этого химического вещества. Непатогенные микробные эпифиты, распыляемые на цветы, могут упреждающе подавлять бактериальный ожог, колонизируя нишу (стигматическую поверхность), используемую бактериями. E. amylovora для увеличения размера эпифитной популяции. Бактерия Pseudomonas fluorescens , штамм A506, зарегистрирован и коммерчески продается для этой цели (BlightBan A506), как и дрожжи, Aureobasidium pullulans (защита от цветов).
E. amylovora стала устойчивой к стрептомицину в некоторых производственных зонах, что ограничивает эффективность этого химического вещества. Непатогенные микробные эпифиты, распыляемые на цветы, могут упреждающе подавлять бактериальный ожог, колонизируя нишу (стигматическую поверхность), используемую бактериями. E. amylovora для увеличения размера эпифитной популяции. Бактерия Pseudomonas fluorescens , штамм A506, зарегистрирован и коммерчески продается для этой цели (BlightBan A506), как и дрожжи, Aureobasidium pullulans (защита от цветов).
Подавление укоренившихся инфекций в середине сезона
Летом укоренившиеся инфекции контролируются главным образом обрезкой. Эффективная борьба с обрезкой требует, чтобы срезы делались на 20–30 см (от 8 до 12 дюймов) ниже видимого конца разрастающейся язвы (рис. 13), а между срезами инструменты для обрезки дезинфицировались хлорной известью или спиртовым раствором, чтобы предотвратить порезы. вырезать передачу. Необходимы повторные посещения сада, так как некоторые инфекции всегда остаются незамеченными, а другие становятся заметными в более позднее время (рис. 14). Обрезки, содержащие возбудителя, обычно уничтожают путем сжигания (рис. 15).
вырезать передачу. Необходимы повторные посещения сада, так как некоторые инфекции всегда остаются незамеченными, а другие становятся заметными в более позднее время (рис. 14). Обрезки, содержащие возбудителя, обычно уничтожают путем сжигания (рис. 15).
| Рисунок 13 | Рисунок 14 | Рисунок 15 |
В сильно пораженных садах методы выращивания, замедляющие скорость роста дерева, также замедляют скорость развития язвы. Это включает в себя отказ от поливной воды, азотных удобрений и культивации. Точно так же методы, которые уменьшают повреждение деревьев и перемещение бактерий, могут уменьшить вторичное инфицирование. Это включает в себя борьбу с насекомыми, такими как клопы и листоблошки, ограничение использования разбрасывателей ветвей в молодых садах и отказ от использования дождевателей. Химические вещества, такие как стрептомицин или медь, могут подавлять травматический ожог, если их применять сразу после града.
Химические вещества, такие как стрептомицин или медь, могут подавлять травматический ожог, если их применять сразу после града.
Значение
Erwinia amylovora является местным патогеном диких розоцветных хозяев в восточной части Северной Америки. К таким хостам относятся боярышник, ирги и рябина. Ранние европейские поселенцы завезли яблоки и груши в Северную Америку. Первое сообщение о бактериальном ожоге как болезни яблони и груши произошло в 1780 году в долине Гудзона в Нью-Йорке. В Калифорнии заболевание было впервые сообщено в 1887 году.
Садоводческие тексты и бюллетени начала 19-го и 20-го веков признавали бактериальный ожог груши серьезным заболеванием, приводили описания симптомов и обрисовывали в общих чертах методы обрезки для борьбы с ним (рис. 16). Тем не менее, на востоке Соединенных Штатов бактериальный ожог оказался губительно эпидемическим для груши, что ограничило культивирование этого растения-хозяина. Даже сегодня угроза бактериального ожога ограничивает коммерческое производство груши полузасушливыми пустынными районами к западу от Скалистых гор.
| Рисунок 16 |
Erwinia amylovora отличается тем, что является первой бактерией, которая оказалась патогенной для растений. постулаты Коха для E. amylovora были выполнены Дж. К. Артуром в 1885 г., но генезис концепции о том, что бактерии могут быть патогенами растений, потребовал вклада многих ученых (в частности, Т. Дж. Беррилла) и растениеводов в период с 1846 по 19 гг.01. E. amylovora также является одним из первых патогенов растений, связанных с насекомыми-переносчиками. В конце 1890-х гг. М.Б. Уэйт связал заражение цветков с перемещением возбудителя от цветка к цветку насекомыми-опылителями.
В течение 20-го века интродукция зараженного растительного материала служила для установления E. amylovora в Европе, на Ближнем Востоке и в Новой Зеландии. В 1995 году бактериальный ожог впервые был обнаружен в долине реки По на севере Италии, которая является крупнейшим районом выращивания груш в мире. С 19В 1995 году итальянское правительство уничтожило 500 000 грушевых деревьев, пытаясь уничтожить Е. амиловора . В последнее время бактериальный ожог распространился на восток от Ближнего Востока до северных предгорий Гималаев в Центральной Азии (Казахстан, Кыргызстан), который является центром происхождения Malus (яблоко) spp.
В 1995 году бактериальный ожог впервые был обнаружен в долине реки По на севере Италии, которая является крупнейшим районом выращивания груш в мире. С 19В 1995 году итальянское правительство уничтожило 500 000 грушевых деревьев, пытаясь уничтожить Е. амиловора . В последнее время бактериальный ожог распространился на восток от Ближнего Востока до северных предгорий Гималаев в Центральной Азии (Казахстан, Кыргызстан), который является центром происхождения Malus (яблоко) spp.
Selected Reading and References
Baker, K. F. 1971. Ожог семечковых плодов: возникновение концепции о том, что бактерии могут быть патогенными для растений. Хилгардия 40:603-633.
Пиво С.В. 1990. Огненный упадок. Страницы 61-63 в:
Сборник болезней яблони и груши и вредителей. Джонс, А.Л., и Олдвинкл, Х.С. (ред.). APS Press, Сент-Пол, Миннесота.
Джонсон, К.Б., и В.О. Стоквелл. 1998. Борьба с бактериальным ожогом: тематическое исследование микробной экологии. Анну. Преподобный Фитопат. 36: 227-248.
Анну. Преподобный Фитопат. 36: 227-248.
Макманус, П. и В. Стоквелл. 2000. Антибиотики для борьбы с болезнями растений: Серебряные пули или ржавые сабли?
Смит, Ти Джей, 2015 г. Разработка и использование Cougar Blight 1990 – 2010: Модель оценки риска бактериального ожога для яблони и груши в зависимости от ситуации.
Туречек, В. В., и Биггс, А. Р. 2015. Maryblyt v. 7.1 для Windows: улучшенная программа прогнозирования бактериального ожога для яблок и груш. Прогресс в области здоровья растений doi: 10.1094/PHP-RS-14-0046.
ван дер Цвет, Т. и С.В. Пиво. 1995. Бактериальный ожог – его природа, профилактика и контроль: практическое руководство по комплексному управлению болезнями. Министерство сельского хозяйства США, Бюллетень сельскохозяйственной информации. № 631.
van der Zwet, T., Orolaza-Halbrendt, N., and Zeller, W. 2012. Ожог: история, биология и управление, APS Press, St. Paul, MN. 460 стр. Ваннесте, Дж. Л. (ред.) 2000. Ожог: болезнь и ее возбудитель, Эрвиния амиловора . Издательство CABI, Уоллингфорд, Великобритания.
Издательство CABI, Уоллингфорд, Великобритания.
Факторы вирулентности Erwinia amylovora: обзор
1. Griffith C.S., Sutton T.B., Peterson P.D. Огненный ожог: Фонд фитобактериологии. АПС Пресс; Сент-Пол, Миннесота, США: 2003. [Google Scholar]
2. Hauben L., Swings J. Род XIII Erwinia . В: Бреннер Д.Дж., Криг Н.Р., Стейли Дж.Т., Гаррити Г.М., редакторы. Руководство Берги по систематической бактериологии. 2-е изд. Том 2Б. Спрингер; Нью-Йорк, штат Нью-Йорк, США: 2005. стр. 670–679. [Google Scholar]
3. Бонн В.Г., ван дер Цвет Т. Распространение и экономическое значение бактериального ожога. В: Vanneste JL, редактор. Ожог: болезнь и ее возбудитель, Erwinia Amylovora. КАБ Интернэшнл; Уоллингфорд, Коннектикут, США: 2000. стр. 37–53. [Академия Google]
4. Томсон С.В. Эпидемиология бактериального ожога. В: Vanneste JL, редактор. Ожог: болезнь и ее возбудитель, Erwinia Amylovora. КАБ Интернэшнл; Уоллингфорд, Великобритания: 2000. стр. 9–36. [Google Scholar]
стр. 9–36. [Google Scholar]
5. Борн Ю., Физелер Л., Клумпп Дж., Югстер М.Р., Зурфлух К., Даффи Б., Лесснер М.Дж. Хвост-ассоциированная деполимераза Erwinia amylovora фага L1 опосредует адсорбцию клетки-хозяина и удаление ферментативной капсулы, что может усилить заражение другим фагом. Окружающая среда. микробиол. 2014;16:2168–2180. дои: 10.1111/1462-2920.12212. [PubMed] [CrossRef] [Google Scholar]
6. Vanneste JL Erwinia Amylovora. Издательство КАБИ; Оксфордшир, Великобритания: 2000. Бактериальный ожог: болезнь и ее возбудитель. [Google Scholar]
7. Ван дер Цвет Т., Оролаза-Хальбрендт Н., Зеллер В. Ожог: история, биология и управление. АПС Пресс; Сент-Пол, Миннесота, США: 2012. [Google Scholar]
8. Сантандер Р.Д., Катала-Сенент Дж.Ф., Марко-Ноалес Э., Биоска Э.Г. Извлечение на планте Erwinia amylovora жизнеспособных, но некультивируемых клеток. Деревья. 2012; 26:75–82. doi: 10.1007/s00468-011-0653-8. [Перекрестная ссылка] [Академия Google]
9. Мэнсфилд Дж., Генин С., Магори С., Читовский В., Сриариянум М., Рональд П., Доу М., Вердье В., Бир С.В., Мачадо М.А. и др. Топ-10 фитопатогенных бактерий в молекулярной фитопатологии. Мол. Завод Патол. 2012;13:614–629. doi: 10.1111/j.1364-3703.2012.00804.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Мэнсфилд Дж., Генин С., Магори С., Читовский В., Сриариянум М., Рональд П., Доу М., Вердье В., Бир С.В., Мачадо М.А. и др. Топ-10 фитопатогенных бактерий в молекулярной фитопатологии. Мол. Завод Патол. 2012;13:614–629. doi: 10.1111/j.1364-3703.2012.00804.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Макманус П.С., Стоквелл В.О., Сундин Г.В., Джонс А.Л. Использование антибиотиков в растениеводстве. Анну. Преподобный Фитопат. 2002; 40:443–465. doi: 10.1146/annurev.phyto.40.120301.093927. [PubMed] [CrossRef] [Google Scholar]
11. Duffy B., Schärer H.-J., Bünter M., Klay A., Holliger E. Нормативные меры против Erwinia amylovora в Швейцарии. Бык ЕОКЗР. 2005; 35: 239–244. doi: 10.1111/j.1365-2338.2005.00820.x. [CrossRef] [Google Scholar]
12. Стоквелл В.О., Даффи Б. Использование антибиотиков в растениеводстве. преподобный наук. Тех. 2012;31:199–210. [PubMed] [Google Scholar]
13. Джонсон К.Б., Стоквелл В.О. Борьба с бактериальным ожогом: пример микробной экологии. Анну. Преподобный Фитопат. 1998;36:227–248. doi: 10.1146/annurev.phyto.36.1.227. [PubMed] [CrossRef] [Google Scholar]
Анну. Преподобный Фитопат. 1998;36:227–248. doi: 10.1146/annurev.phyto.36.1.227. [PubMed] [CrossRef] [Google Scholar]
14. Норелли Дж.Л., Джонс А.Л., Олдвинкл Х.С. Борьба с бактериальным ожогом в двадцать первом веке: использование новых технологий, повышающих сопротивляемость яблони-хозяина. Завод Дис. 2003; 87: 756–765. doi: 10.1094/PDIS.2003.87.7.756. [CrossRef] [Google Scholar]
15. Zeng Q., Sundin G.W. Полногеномная идентификация малых РНК, регулируемых Hfq, у возбудителя бактериального ожога Erwinia amylovora обнаружила малые РНК с функцией регуляции вирулентности. Геномика BMC. 2014; 15 doi: 10.1186/1471-2164-15-414. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Томсон С.В. Роль стигмы при бактериальном ожоге. Фитопатология. 1986; 76: 476–482. doi: 10.1094/Фито-76-476. [CrossRef] [Google Scholar]
17. Dellagi A., Brisset M.N., Paulin J.P., Expert D. Двойная роль десферриоксамина в патогенности Erwinia amylovora . Мол. Взаимодействие растительных микробов. 1998; 11: 734–742. doi: 10.1094/MPMI.1998.11.8.734. [PubMed] [CrossRef] [Google Scholar]
Мол. Взаимодействие растительных микробов. 1998; 11: 734–742. doi: 10.1094/MPMI.1998.11.8.734. [PubMed] [CrossRef] [Google Scholar]
18. Малной М., Мартенс С., Норелли Дж. Л., Барни М. А., Сундин Г. В., Смитс Т. Х., Даффи Б. Бактериальный ожог: прикладное геномное понимание патогена и хозяина. Анну. Преподобный Фитопат. 2012; 50: 475–49.4. doi: 10.1146/annurev-phyto-081211-172931. [PubMed] [CrossRef] [Google Scholar]
19. Koczan J.M., Lenneman B.R., McGrath M.J., Sundin G.W. Структуры прикрепления клеточной поверхности способствуют образованию биопленки и колонизации ксилемы Erwinia amylovora . заявл. Окружающая среда. микробиол. 2011;77:7031–7039. doi: 10.1128/AEM.05138-11. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
20. Манн Р.А., Смитс Т.Х., Бюльманн А., Блом Дж., Гесманн А., Фрей Дж.Э., Пламмер К.М., Бир С.В., Лак Дж., Даффи Б. и др. Сравнительная геномика 12 штаммов из Erwinia amylovora идентифицирует пангеном с большим консервативным ядром. ПЛОС ОДИН. 2013;8:e55644. doi: 10.1371/journal.pone.0055644. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
ПЛОС ОДИН. 2013;8:e55644. doi: 10.1371/journal.pone.0055644. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
21. Koczan J.M., McGrath M.J., Zhao Y., Sundin G.W. Вклад экзополисахаридов Erwinia amylovora амиловорана и левана в образование биопленки: влияние на патогенность. Фитопатология. 2009; 99: 1237–1244. doi: 10.1094/PHYTO-99-11-1237. [PubMed] [CrossRef] [Академия Google]
22. Бурс А., Вайнгарт Х., Ульрих М.С. NorM, насос Erwinia amylovora для оттока нескольких лекарств, участвующий в конкуренции in vitro с другими эпифитными бактериями. заявл. Окружающая среда. микробиол. 2004; 70: 693–703. doi: 10.1128/AEM.70.2.693-703.2004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Ordax M., Marco-Noales E., Lopez M.M., Biosca E.G. Экзополисахариды способствуют выживанию Erwinia amylovora в условиях стресса меди с помощью различных стратегий. Рез. микробиол. 2010;161:549–555. doi: 10.1016/j. resmic.2010.05.003. [PubMed] [CrossRef] [Google Scholar]
resmic.2010.05.003. [PubMed] [CrossRef] [Google Scholar]
24. Vrancken K., Holtappels M., Schoofs H., Deckers T., Valcke R. Патогенность и стратегии заражения возбудителем бактериального ожога Erwinia amylovora in Rosaceae : Уровень развития. Микробиология. 2013; 159: 823–832. doi: 10.1099/микрофон 0.064881-0. [PubMed] [CrossRef] [Google Scholar]
25. Bellemann P., Bereswill S., Berger S., Geider K. Визуализация формирования капсулы с помощью Erwinia amylovora и анализы для определения синтеза амиловорана. Междунар. Дж. Биол. макромол. 1994; 16: 290–296. doi: 10.1016/0141-8130(94)
-2. [PubMed] [CrossRef] [Google Scholar]
26. Ramey B.E., Koutsoudis M., von Bodman S.B., Fuqua C. Образование биопленок в растительно-микробных ассоциациях. Курс. мнение микробиол. 2004; 7: 602–609. doi: 10.1016/j.mib.2004.10.014. [PubMed] [CrossRef] [Google Scholar]
27. Maes M., Orye K., Bobev S., Devreese B., van Beumen J., de Bruyn A., Busson R. , Herdewijn P., Morreel K. ., Messens E. Влияние продукции амиловорана на вирулентность Erwinia amylovora и другая структура амиловорана в изолятах E. amylovora из Rubus . Евро. Дж. Плант Патол. 2001; 107: 839–844. doi: 10.1023/A:1012215201253. [CrossRef] [Google Scholar]
, Herdewijn P., Morreel K. ., Messens E. Влияние продукции амиловорана на вирулентность Erwinia amylovora и другая структура амиловорана в изолятах E. amylovora из Rubus . Евро. Дж. Плант Патол. 2001; 107: 839–844. doi: 10.1023/A:1012215201253. [CrossRef] [Google Scholar]
28. Нимц М., Морт А., Домке Т., Рэй В., Чжан Ю., Цю Ф., Коплин Д., Гейдер К. Структура амиловорана, капсульного экзополисахарида из возбудитель бактериального ожога Erwinia amylovora . углевод. Рез. 1996; 287: 59–76. doi: 10.1016/0008-6215(96)00070-5. [PubMed] [CrossRef] [Академия Google]
29. Schollmeyer M., Langlotz C., Huber A., Coplin D.L., Geider K. Вариации молекулярных масс капсульных экзополисахаридов амиловоран, пирифолан и стевартан. Междунар. Дж. Биол. макромол. 2012; 50: 518–522. doi: 10.1016/j.ijbiomac.2012.01.003. [PubMed] [CrossRef] [Google Scholar]
30. Bellemann P., Geider K. Локализация вставок транспозонов в патогенных мутантах Erwinia amylovora и их биохимическая характеристика. J. Gen. Microbiol. 1992;138:931–940. doi: 10.1099/00221287-138-5-931. [PubMed] [CrossRef] [Google Scholar]
J. Gen. Microbiol. 1992;138:931–940. doi: 10.1099/00221287-138-5-931. [PubMed] [CrossRef] [Google Scholar]
31. Bugert P., Geider K. Характеристика продукта гена amsI как низкомолекулярной кислой фосфатазы, контролирующей синтез экзополисахарида Erwinia amylovora . ФЭБС лат. 1997; 400: 252–256. doi: 10.1016/S0014-5793(96)01398-1. [PubMed] [CrossRef] [Google Scholar]
32. Истгейт Дж.А. Erwinia amylovora : молекулярная основа бактериального ожога. Мол. Завод Патол. 2000; 1: 325–329.. doi: 10.1046/j.1364-3703.2000.00044.x. [PubMed] [CrossRef] [Google Scholar]
33. Langlotz C., Schollmeyer M., Coplin D., Nimtz M., Geider K. Биосинтез повторяющихся звеньев экзополисахаридов амилоран из Erwinia amylovora и стивартан из Pantoea stewartii . Физиол. Мол. Завод Патол. 2011;75:163–169. doi: 10.1016/j.pmpp.2011.04.001. [CrossRef] [Google Scholar]
34. Гросс М., Гейер Г., Рудольф К., Гейдер К. Леван и левансахараза, синтезированная возбудителем бактериального ожога Эрвиния амиловора . Физиол. Мол. Завод Патол. 1992; 40: 371–381. doi: 10.1016/0885-5765(92)
Физиол. Мол. Завод Патол. 1992; 40: 371–381. doi: 10.1016/0885-5765(92)
-U. [CrossRef] [Google Scholar]35. Гейер Г., Гейдер К. Характеристика и влияние на вирулентность гена левансахаразы возбудителя бактериального ожога Erwinia amylovora . физ. Мол. Завод Патол. 1993; 42: 387–404. doi: 10.1006/pmpp.1993.1029. [CrossRef] [Google Scholar]
36. Khokhani D., Zhang C., Li Y., Wang Q., Zeng Q., Yamazaki A., Hutchins W., Zhou S.S., Chen X., Yang C.H. Открытие растительных фенольных соединений, которые действуют как ингибиторы системы секреции III типа или индукторы возбудителя бактериального ожога, Эрвиния амиловора . заявл. Окружающая среда. микробиол. 2013;79:5424–5436. doi: 10.1128/AEM.00845-13. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Jin Q., Hu W., Brown I., McGhee G., Hart P., Jones A.L., He S.Y. Визуализация секретируемых белков Hrp и Avr вдоль пилуса Hrp во время секреции типа III у Erwinia amylovora и Pseudomonas syringae .
Мол. микробиол. 2001;40:1129–1139. doi: 10.1046/j.1365-2958.2001.02455.x. [PubMed] [CrossRef] [Академия Google]
38. О С.-С., Бер С.В. Молекулярная генетика Erwinia amylovora , участвующих в развитии бактериального ожога. ФЭМС микробиол. лат. 2005; 253:185–192. doi: 10.1016/j.femsle.2005.09.051. [PubMed] [CrossRef] [Google Scholar]
39. Бюттнер Д., Хе С.Ю. Секреция белков типа III у фитопатогенных бактерий. Завод Физиол. 2009; 150:1656–1664. doi: 10.1104/стр.109.139089. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Барнхарт М. М., Чепмен М. Р. Биогенез и функция Керли. Анну. Преподобный Микробиолог. 2006; 60: 131–147. doi: 10.1146/annurev.micro.60.080805.142106. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Эпштейн Э.А., Чепмен М.Р. Полимеризация волокна между бактериями и клетками-хозяевами: биогенез функциональных амилоидных волокон. Клеточная микробиология. 2008;10:1413–1420. doi: 10.1111/j.1462-5822.2008.
01148.x. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
, и другие. Полная последовательность генома фитопатогена Erwinia amylovora , штамм ATCC 49946. J. Bacteriol. 2010;192:2020–2021. doi: 10.1128/JB.00022-10. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Смитс Т.Х., Реццонико Ф., Камбер Т., Блом Дж., Гесманн А., Фрей Дж.Э., Даффи Б. Полная последовательность генома огня возбудитель фитофтороза Erwinia amylovora CFBP 1430 и сравнение с другими Erwinia spp. Мол. Взаимодействие растительных микробов. 2010;23:384–393. doi: 10.1094/MPMI-23-4-0384. [PubMed] [CrossRef] [Академия Google]
44. Дэйви М.Э., О’Тул Г.А. Микробные биопленки: от экологии к молекулярной генетике. микробиол. Мол. биол. 2000; 64:847–867. doi: 10.1128/MMBR.64.4.847-867.2000. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Sauer K., Camper A.K., Ehrlich G.D., Costerton J.W., Davies D.G. Pseudomonas aeruginosa проявляет несколько фенотипов во время развития в виде биопленки.
Дж. Бактериол. 2002; 184:1140–1154. doi: 10.1128/jb.184.4.1140-1154.2002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
46. Сантандер Р.Д., Оливер Дж.Д., Биоска Э.Г. Клеточные, физиологические и молекулярные адаптивные реакции Erwinia amylovora на голодание. ФЭМС микробиол. Экол. 2014; 88: 258–271. doi: 10.1111/1574-6941.12290. [PubMed] [CrossRef] [Google Scholar]
47. Чжао Ю., Ван Д., Накка С., Сундин Г.В., Корбан С.С. Анализ системного уровня двухкомпонентных систем передачи сигналов в Erwinia amylovora : Роль в вирулентности , регуляция биосинтеза амиловорана и роевой подвижности. Геномика BMC. 2009 г.;10 doi: 10.1186/1471-2164-10-245. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
48. Реззонико Ф., Браун-Кьюник А., Манн Р.А., Гесманн А., Родони Б., Даффи Б., Смитс Т.Х.М. Гены биосинтеза липополисахарида различают Rubus — и Spiraeoideae-инфицирующие генотипы Erwinia amylovora . Мол. Завод Патол.
2012;13:975–984. doi: 10.1111/j.1364-3703.2012.00807.x. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
49. Fukuoka S., Brandenburg K., Müller M., Lindner B., Koch M.H., Seydel U. Физико-химический анализ фракций липидов А липополисахарид из Erwinia carotovora в отношении биологической активности. Биохим. Биофиз. Акта. 2001; 1510: 185–197. doi: 10.1016/S0005-2736(00)00347-3. [PubMed] [CrossRef] [Google Scholar]
50. Zhang Y., Bak DD, Heid H., Geider K. Молекулярная характеристика протеазы, секретируемой Erwinia amylovora . Дж. Мол. биол. 1999; 289:1239–1251. doi: 10.1006/jmbi.1999.2846. [PubMed] [CrossRef] [Google Scholar]
51. Wu J.W., Chen XL. Внеклеточные металлопротеазы бактерий. заявл. микробиол. Биотехнолог. 2011;92: 253–262. doi: 10.1007/s00253-011-3532-8. [PubMed] [CrossRef] [Google Scholar]
52. Ваннесте Дж. Л. Патогенез и специфичность хозяина при болезнях растений: гистопатологические, биохимические, генетические и молекулярные основы.
В: Сингх США, Сингх Р.П., Комото К., редакторы. Прокариоты. Том 1. Пергамон Пресс; Оксфорд, Великобритания: 1995. стр. 21–41. [Google Scholar]
53. Фейстнер Г.Дж., Шталь Д.К., Габрик А.Х. Проферриоксаминовые сидерофоры Erwinia amylovora . Капиллярная жидкостная хроматография/масс-спектрометрия в тандеме с электрораспылением. Орг. Масс-спектр. 1993;28:163–175. doi: 10.1002/oms.1210280307. [CrossRef] [Google Scholar]
54. Kachadourian R., Dellagi A., Laurent J., Bricard L., Kunesch G., Expert D. Десферриоксамин-зависимый транспорт железа в Erwinia amylovora CFBP 1430: Клонирование ген, кодирующий рецептор ферриоксамина FoxR. Биометаллы. 1996; 9: 143–150. doi: 10.1007/BF00144619. [PubMed] [CrossRef] [Google Scholar]
55. Aldridge P., Metzger M., Geider K. Генетика метаболизма сорбита у Erwinia amylovora и его влияние на вирулентность бактерий. Мол. Генерал Жене. 1997; 256:611–619. doi: 10.1007/s004380050609. [PubMed] [CrossRef] [Google Scholar]
56.
Grant CR, Rees T. Метаболизм сорбита в саженцах яблони. Фитохимия. 1981; 20: 1505–1511. doi: 10.1016/S0031-9422(00)98521-2. [CrossRef] [Google Scholar]
57. Валарт Р.А. Распределение сорбита в Rosaceae . Фитохимия. 1980; 19: 2603–2610. doi: 10.1016/S0031-9422(00)83927-8. [Перекрестная ссылка] [Академия Google]
58. Богс Дж., Гейдер К. Молекулярный анализ метаболизма сахарозы Erwinia amylovora и влияние на вирулентность бактерий. Дж. Бактериол. 2000;182:5351–5358. doi: 10.1128/JB.182.19.5351-5358.2000. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
59. Dreo T., Ravnikar M., Frey J.E., Smits T., Duffy B. In silico анализ переменного числа тандемных повторов в Erwinia amylovora генома. Акта Хортик. 2011; 896: 115–118. [Google Академия]
60. Rezzonico F., Smits TH, Duffy B. Разнообразие, эволюция и функциональность сгруппированных регулярно расположенных коротких палиндромных повторов (CRISPR) в возбудителе бактериального ожога Erwinia amylovora .
заявл. Окружающая среда. микробиол. 2011;77:3819–3829. doi: 10.1128/AEM.00177-11. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
61. McManus P.S., Jones A.L. Генетическая дактилоскопия штаммов Erwinia amylovora , выделенных из древесно-плодовых культур, и Rubus вид. Фитопатология. 1995; 85: 1547–1553. doi: 10.1094/Phyto-85-1547. [CrossRef] [Google Scholar]
62. Смитс Т.Х., Реззонико Ф., Даффи Б. Эволюционные выводы из геномики Erwinia amylovora . Дж. Биотехнология. 2011; 155:34–39. doi: 10.1016/j.jbiotec.2010.10.075. [PubMed] [CrossRef] [Google Scholar]
63. Смитс Т.Х., Герреро-Прието В.М., Эрнандес-Эскарсега Г., Блом Дж., Гесманн А., Реззонико Ф., Даффи Б., Стоквелл В.О. Полногеномное секвенирование Erwinia amylovora Штаммы из Мексики обнаруживают одиночные нуклеотидные полиморфизмы в rpsL, придающем резистентность к стрептомицину, и в эффекторных взаимодействиях avrRpt2, изменяющих хозяина. Объявление генома.
2014; 2 doi: 10.1128/genomeA.01229-13. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
64. De Léon-Door A.P., Romo Chacón A., Acosta Muñiz C. Обнаружение устойчивости к стрептомицину у штаммов Erwinia amylovora , выделенных из яблони в Чиуауа. , Мексика. Евро. Дж. Плант Патол. 2013;137:223–229. doi: 10.1007/s10658-013-0241-4. [CrossRef] [Google Scholar]
65. Асселин Дж.Э., Бонасера Дж.М., Ким Дж.Ф., О К.С., Бир С.В. Eop1 из штамма Rubus штамма Erwinia amylovora действует как фактор, ограничивающий круг хозяев. Фитопатология. 2011; 101:935–944. doi: 10.1094/PHYTO-12-10-0339. [PubMed] [CrossRef] [Google Scholar]
66. Манн Р.А., Блом Дж., Бюльманн А., Пламмер К.М., Бир С.В., Лак Дж.Э., Гесманн А., Фрей Дж.Э., Родони Б.С., Даффи Б. и др. . Сравнительный анализ острова патогенности Hrp Rubu s- и Spiraeoideae-инфицирующие штаммы Erwinia amylovora идентифицируют IT-область как остаток интегративного конъюгативного элемента.
Ген. 2012; 504:6–12. doi: 10.1016/j.gene.2012.05.002. [PubMed] [CrossRef] [Google Scholar]
67. Иган Ф., Рин Ф.Дж., О’Гара Ф. Распределение и разнообразие наборов метагеномных данных выявляет нишевую специализацию. Окружающая среда. микробиол. Отчет 2015; 7: 194–203. дои: 10.1111/1758-2229.12222. [PubMed] [CrossRef] [Академия Google]
68. Nakka S., Qi M., Zhao Y. Система PmrAB в Erwinia amylovora делает патоген более восприимчивым к полимиксину B и более устойчивым к избытку железа. Рез. микробиол. 2010; 161:153–157. doi: 10.1016/j.resmic.2009.12.001. [PubMed] [CrossRef] [Google Scholar]
69. Молина Л., Реццонико Ф., Дефаго Г., Даффи Б. Автоиндукция в Erwinia amylovora : свидетельство наличия сигнала ацил-гомосеринлактона в возбудителе бактериального ожога. Дж. Бактериол. 2005; 187:3206–3213. дои: 10.1128/JB.187.9.3206-3213.2005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
70. Вентури В., Венути К., Девескови Г., Луккезе К.
, Фрискина А., Деграсси Г., Агилар К., Маццукки У. Патоген растений Erwinia amylovora продуцирует сигнальные молекулы ацил-гомосеринлактона in vitro и in planta. ФЭМС микробиол. лат. 2004; 241:179–183. doi: 10.1016/j.femsle.2004.10.015. [PubMed] [CrossRef] [Google Scholar]
71. Rezzonico F., Duffy B. Роль luxS в возбудителе бактериального ожога Erwinia amylovora ограничена метаболизмом и не включает определение кворума. Мол. Взаимодействие растительных микробов. 2007; 20:1284–129.7. doi: 10.1094/MPMI-20-10-1284. [PubMed] [CrossRef] [Google Scholar]
72. Gao Y., Song J., Hu B., Zhang L., Liu Q., Liu F. Ген luxS участвует в производстве AI-2, патогенность и некоторые фенотипы у Erwinia amylovora . Курс. микробиол. 2009; 58:1–10. doi: 10.1007/s00284-008-9256-z. [PubMed] [CrossRef] [Google Scholar]
73. Castiblanco L.F., Edmunds A.C., Waters C.M., Sundin G.W. Характеристика систем определения кворума и сигнальных систем циклического ди-GMP в Эрвиния амиловора .
Фитопатология. 2011;101:S2. [Google Scholar]
74. Edmunds A.C., Castiblanco L.F., Sundin G.W., Waters C.M. Циклический Di-GMP модулирует прогрессирование заболевания Erwinia amylovora . Дж. Бактериол. 2013;195:2155–2165. doi: 10.1128/JB.02068-12. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
75. Ancona V., Lee J.H., Chatnaparat T., Oh J., Hong J.I., Zhao Y. Bacterial Alarmone (p)ppGpp активирует тип III Система секреции Erwinia amylovora. Дж. Бактериол. 2015;197:1433–1443. doi: 10.1128/JB.02551-14. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
76. Сиамер С., Гийяс И., Симобаяши М., Кунц С., Холл М.Н., Барни М.А. Экспрессия бактериального эффектора типа III DspA/E у Saccharomyces cerevisiae подавляет путь биосинтеза сфинголипидов, что приводит к остановке роста. Дж. Биол. хим. 2014; 289:18466–18477. doi: 10.1074/jbc.M114.562769. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
77. Siamer S., Patrit O., Fagard M.
, Belgareh-Touzé N., Barny M.A. Экспрессия эффектора DspA/E Erwinia amylovora типа III в дрожжи Saccharomyces cerevisiae сильно изменяют клеточный транспорт. Открытая биол. ФЭБС. 2011; 1:23–28. doi: 10.1016/j.fob.2011.11.001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
78. Degrave A., Moreau M., Launay A., Barny M.A., Brisset M.N., Patrit O., Taconnat L., Vedel R., Fagard M. Бактериальный эффектор DspA/E токсичен для Arabidopsis thaliana и необходим для размножения и выживания возбудителя бактериального ожога. Мол. Завод Патол. 2013; 14: 506–517. doi: 10.1111/mpp.12022. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
79. Wei Z., Kim J.F., Beer S.V. Регуляция генов hrp и секреции белков типа III у Erwinia amylovora с помощью новой двухкомпонентной системы HrpX/HrpY и HrpS. Мол. Взаимодействие растительных микробов. 2000;13:1251–1262. дои: 10.1094/МПМИ.2000.13.11.1251. [PubMed] [CrossRef] [Google Scholar]
80. Wei Z.M., Beer S.V. hrpL активирует транскрипцию гена hrp Erwinia amylovora и является членом подсемейства s-факторов ECF.
