Как ухаживать за голубикой летом
В последние годы у российских садоводов большой популярностью пользуется голубика высокорослая, которая может принести богатый урожай очень вкусных и полезных ягод, цены на которые в магазинах просто зашкаливают.
Голубика садовая – невысокий (до 1,5 м) листопадный, плодовый, перекрестно опыляемый кустарник из семейства Вересковые. Он очень неприхотлив, практически не болеет и не поражается вредителями. К тому же культура обладает высокой морозостойкостью (до – 32 градусов).
Для хорошего роста и обильного плодоношения высокорослой голубики, необходимо соблюсти очень важное условие – правильно закислить почву в корнеобитаемом слое (до рН 3 – 3,5). Если этого не сделать, то кустарник будет плохо расти, а затем и вовсе погибнет.
Об истории появления высокорослой голубики садовой, о полезных свойствах ее ягод, о том как ее правильно посадить мы уже писали в своей опубликованной статье:
«Как вырастить голубику»
Сегодня мы поговорим о том, как правильно ухаживать за голубикой в летний период. Ведь именно летом закладывается урожай будущего года. Да и текущий нужно сохранить без потерь.
ВАЖНЫЕ ОСОБЕННОСТИ ВЫРАЩИВАНИЯ ГОЛУБИКИ
Самое важное условие для выращивания здоровой и обильно плодоносящей голубики – постоянно поддерживать вокруг ее корней высокую кислотность.
Кроме того, голубике нужна очень плодородная, рыхлая, хорошо проветриваемая почва.
Культуре также требуется много солнца и обильные, регулярные поливы.
Основную подготовку почвы проводите при посадке, заменяя «родной» грунт в посадочных ямах на искусственно составленный из плодородного слоя, перегноя (или перепревшего навоза), хвойного опада, торфа и песка в равных количествах.
В качестве мульчирующего слоя в приствольный круг уложите еловые или сосновые шишки. Затем посадочные ямы хорошо пролейте обычной водой так, чтобы она стояла на поверхности.
После этого приготовьте закисляющий раствор. В ведре теплой воды растворите 4 столовые ложки лимонной кислоты, хорошо перемешайте, чтобы не осталось крупинок, которые могут сжечь корни растений, и залейте этот раствор в каждую посадочную яму (одно ведро под одно растение).
В ведре теплой воды растворите 4 столовые ложки лимонной кислоты, хорошо перемешайте, чтобы не осталось крупинок, которые могут сжечь корни растений, и залейте этот раствор в каждую посадочную яму (одно ведро под одно растение).
Ни в коем случае не используйте для закисления уксус, жидкость из аккумулятора и другую химию!
Не забывайте, что растения – живые, и их легко можно отравить!
На следующий день еще раз пролейте грунт в посадочных ямах чистой водой и приступайте к посадке.
При выборе места под посадку помните, что голубика не выносит даже кратковременного затенения. Она весь световой день должна буквально «купаться» в солнечных лучах. Только тогда кусты будут хорошо расти и приносить вам высокие урожаи.
И, конечно, не жалейте воды при поливах!
Не все сорта голубики – самоплодные. Поэтому, если вы решили выращивать эту культуру, то сажайте рядом как минимум два разных сорта.
КАК УХАЖИВАТЬ ЗА ГОЛУБИКОЙ С ВЕСНЫ ДО ОСЕНИ
Удобрение. Первый раз голубику подкормите в конце марта – начале апреля. Для этого используйте раствор мочевины (2 ст. ложки на ведро теплой воды под каждое растение).
Первый раз голубику подкормите в конце марта – начале апреля. Для этого используйте раствор мочевины (2 ст. ложки на ведро теплой воды под каждое растение).
В конце мая и конце июня дайте кустам голубики натуральную органику. Лучше всего – раствор навозной жижи в концентрации с водой 1:10 (одно ведро на два куста после обильного полива чистой водой).
В августе, когда созревает основной урожай, голубика нуждается в фосфоре и калии. Внесите под кусты суперфосфат (2 ст. ложки под куст) и сернокислый калий (1,5 ст. ложки под одно растение).
Осенью (в начале октября) дайте всем кустам какой-то готовый минеральный комплекс для осенней подкормки плодовых кустарников (типа «Кемира осенняя»). Придерживайтесь доз, указанных на упаковке.
Периодическое закисление почвы. Его необходимо проводить два раза за сезон: весной – в конце апреля и осенью – в начале сентября.
Используйте более слабый раствор лимонной кислоты, чем при посадке (2 ст. ложки на ведро воды под каждое растение). Перед закислением, хорошо полейте все кусты обычной водой.
Перед закислением, хорошо полейте все кусты обычной водой.
Полив. Голубика – растение-водохлеб. В жару ее нужно поливать 3 – 4 раза в неделю. При недостатке влаги, она просто сбросит все завязи!
При высоких температурах воздуха весь куст необходимо окутать мельчайшими водяными брызгами с помощью мелкодисперсного дождевания. Операцию эту проводите либо поздно вечером, либо ранним утром.
В нежаркую сухую погоду голубике достаточно двух поливов в неделю (4 ведра под каждый куст).
В любом случае следите за состоянием почвы в приствольных кругах. Она всегда должна быть сильно влажной и рыхлой, но без стоящих лужиц.
Мульчирование. Сосновых и еловых шишек, уложенных в приствольных кругах голубики в качестве мульчирующего слоя, недостаточно. Сверху насыпьте хвойный опад или торфяную крошку слоем 5 см.
Мульча поможет дольше сохранять влагу в почве. К тому же она будет препятствовать росту сорняков вокруг растений.
Обрезка. Для голубики применяйте в основном санитарную обрезку. Удаляйте все сухие, поломанные, подмерзшие, загущающие (растущие внутрь куста) и старые ветви.
Куст всегда должен хорошо проветриваться и целиком освещаться солнцем. Только тогда вы сможете получить крупные, сладкие и вкусные ягоды в большом количестве.
Подготовка к зиме. В первые 3 года приствольные круги обязательно нужно утеплять. Засыпьте их осенью сухими листьями слоем 50 см, а сверху уложите еловый лапник в один слой.
Взрослые кусты утепляйте только если вы живете в северных регионах с сильными зимними холодами. Используйте для этого также сухие листья и еловый лапник.
ЛУЧШИЕ СОРТА ГОЛУБИКИ ИЗ НАШЕЙ КОЛЛЕКЦИИ
Мы рассказали, как ухаживать за голубикой в летнее время. Теперь хотим представить вам лучшие сорта этой замечательной плодово-ягодной культуры из нашей коллекции.
Новинка:
Река.
Наша коллекция:
Олле, Эмиль, Пелле, Голубое золото, Патриот, Дюк, Чиппева.
Подробнее об этих сортах читайте на нашем сайте и в каталоге «ОСЕНЬ 2021».
А купить их у нас или заказать для осенней посадки вы можете уже сегодня!
Голубика в Сибири: посадка и уход
На земном шаре все виды голубики распределены неравномерно. Самую обширную территорию занимает голубика топяная (Vaccinium uliginosum L.). В любительских садах Сибири она почти не распространена. Одна из причин — недостаточное количество посадочного материала: голубика трудно укореняется, а укоренившийся черенок медленно растет. Какие же выбрать сорта и как правильно посадить голубику, чтобы наслаждаьбся урожаем витаминной и вкусной ягоды.
Посадка голубики в Сибири
Прежде всего нужно выбрать правильное место под голубики — достаточно освещенное, влажное. При посадке добавить торф, немного закислить почву и внести минеральное удобрение.
Голубика топяная может расти и плодоносить на одном месте до 30-40 лет.
Голубику мы рекомендуем высаживать на открытом освещенном и влажном участке, не ближе 20–30 м от больших деревьев (сосна, береза, осина), потому что они потребляют много влаги.
- Голубику лучше выращивать на солнечном месте. Для закладки плодовых почек ягоде необходим свет.
- В природных условиях, в тени, урожайность голубики намного ниже, чем в более освещенных местах.
- Хотя голубика и предпочитает влажные места, ее нельзя высаживать в низинах, так как существует опасность заболачивания.
- У растений, долгое время растущих в почве с избыточным количеством влаги, загнивают, а затем и отмирают корни, так как из-за недостатка кислорода нарушаются процессы дыхания и обмена веществ.
- Уровень стояния грунтовых вод должен быть не менее, чем 30–40 см от поверхности почвы.
Почва под голубику
Почва под голубику должна быть слабокислой, это важное условие.
- Допускается кислотность почвы (рН) 3,5–5,0.

- Необходимая кислотность достигается внесением торфа верхового болота и внесением комплексного минерального удобрения, обязательно содержащего серу. Норма внесения минерального удобрения – по инструкции, прилагаемой к удобрению. Удобрение надо тщательно перемешать с почвой.
| Голубика усваивает питательные вещества через микоризу (грибокорень). |
Микориза хорошо растет и развивается во влажной и кислой почве.
- Микориза может присутствовать в почвах из-под берез или сосен, растущих во влажном лесу. Следовательно, если добавить в посадочную яму такую почву, то, вероятнее всего, там будет и микориза.
- Саженец голубики тоже содержит микоризу. Поэтому при посадке всю почву из горшочка надо положить в посадочную яму.
- Для посадки голубики выкапываем яму размером 40х40х50 см.
- Засыпаем в нее почвенную смесь в соотношении: торф – 2 части, песок – 1 часть, земля из-под березы – 1 часть.
Можно заполнить посадочную ямку одним торфом. Почва должна быть рыхлой.
- Расстояние между кустами выдерживаем в 1 м.
- Голубику при посадке заглубить не более 2 см от зоны расположения корней.
Под высокорослую голубику ямку выкапываем немного больше и глубже.
- Посадочное место следует обильно полить до и после посадки.
- Почву уплотнить и сверху замульчировать сухим торфом слоем не более 2 см.
Сорта голубики лучше приобретать в надежных торговых организациях. Сортов голубики топяной в продаже пока нет. Лучшим посадочным материалом являются двухтрехлетние саженцы с закрытой корневой системой.
Сорта голубики условно разделены по высоте куста на 3 группы:
- высокорослые. Самые урожайные из них относятся к группе высокорослых голубик благодаря высоким кустам и большому числу крупных ягод в кисти.
 В условиях Сибири, из-за недостатка тепла, они не успевают за лето пройти полный цикл роста и развития, что отражается на их зимостойкости и урожайности.
В условиях Сибири, из-за недостатка тепла, они не успевают за лето пройти полный цикл роста и развития, что отражается на их зимостойкости и урожайности. - полувысокие. Полувысокие голубики более приспособлены для Сибири.
- низкорослые. Канадские низкорослые голубики и голубика топяная более зимостойки.
Многолетний опыт выращивания различных видов и сортов голубики в условиях Центрального сибирского ботанического сада СО РАН показал, что для Сибири лучше всего подходят сорта высокорослой голубикиДюк и полувысокойНортблу и Норткантри.
Сорта голубики топяной, созданные в ЦСБС:
- Голубая россыпь,
- Дивная,
- Изящная,
- Иксинская,
- Нектарная,
- Таежная красавица,
- Шегарская (в условиях ЦСБС один куст голубики топяной сорта Шегарская имеет возраст сорок лет и дает ежегодный урожай до 1–1,5 кг),
- Юрковская.

В условиях Сибири максимальный урожай голубики топяной – 2,5 кг, полувысокой – 3 кг с куста.
___________________________________________________________________
РАЗМНОЖЕНИЕ ГОЛУБИКИ СЕМЕНАМИ
Уход за голубикой в СибириОсновной уход за голубикой включает полив, подкормку, ежегодную подсыпку растений торфом и защиту от болезней и вредителей.
Полив и мульчирование голубики
Голубике необходимо больше влаги, чем большинству садовых растений, поэтому она нуждается в ежедневном поливе. Особенно это важно в сухие, очень жаркие дни
- При поливе не следует допускать переувлажнения почвы.
- Если нет возможности поливать ежедневно, то голубику можно притенить в полуденные часы. Для этого достаточно поставить небольшой деревянный каркас, обтянутый белым укрывным материалом так, чтобы тень от него попадала на весь кустик голубики. Каркас необходимо закрепить.
Голубику необходимо ежегодно мульчировать (подсыпать торф) слоем около 10 см. Это способствует разрастанию куста вширь и повышению урожайности.
Это способствует разрастанию куста вширь и повышению урожайности.
Подкормки голубики
Лучший срок внесения минеральных удобрений – начало весны, в период набухания почек.
- На почвах с оптимальным значением рН под взрослый куст рекомендуется вносить 90 г сульфата аммония, 40 г сульфата калия и 110 г суперфосфата или 200–250 г удобрения Кемира для вечнозеленых хвойных;
- под молодые кусты надо вносить в 2-3 раза меньше удобрений.
Болезни и вредители голубики
Все приемы агротехники, обеспечивающие оптимальный рост и развитие растений, в значительной степени снижают и уровень повреждения их патогенами.
Болезни у голубики, в основном, грибные – у высокорослой голубики – рак стебля. Вредители – различные листовертки.
- Зимой голубику надо защищать от мышей и зайцев. Лучше всего осенью укрывать кусты сосновыми ветками таким образом, чтобы снег во время его уплотнения не сломал хрупкие побеги голубики.

- Для профилактики сразу после таяния снега и перед выпадением снега желательно обрабатывать кусты бордоской жидкостью (1%).
Татьяна Ивановна Снакина, кандидат биологических наук
Голубика — особенности выращивания — Сияние
|
Голубика садовая — это самая вкусная ягода! Если не верите, то придите в гости к вашим знакомым, у кого она растет и попробуйте спелые ягоды прямо с куста. Если у ваших знакомых хватит сообразительности, то они вас от голубики уведут силком и попросят приходить к ним в гости только в зимнее время. Потому что вы сами от ягод оторваться не сможете. На моем садовом участке голубика растет с 2013 года и все это время мы всегда ждем того момента, как её ягоды начинают поспевать. В это время все стараются находиться поближе к её кустам. Это все очень хорошо, но выращивание голубики имеет свои особенности, без которых у вас не то, что будет мало ягод, но ваши кусты могут быть без ягод вообще! Вот о некоторых таких важных особенностях вы и узнаете в этой статье.  Я Наталья Иванцова, руководитель новосибирского садового центра природного земледелия «Сияние». |
|
Все вышерассказанное мной о вкусе голубики это правда — вот документальное свидетельство — «ягоды голубики едят мои внуки».
А это брат мужа, попробовал у нас ягод и тут же посадил голубику у себя. Единственная проблема у него — ягоды в первую очередь съедают те, кто в посадке и уходу за этим ягодным кустарником не участвовал.А это видео о его голубике
А это еще одно фото голубики, которая растет на садовом участке у одного садовода в Новосибирске.
И тут приближаемся к сути статьи. Когда голубика начала плодоносить на нашем демонстрационном участке, то мы стали угощать ею садоводов — посетителей ландшафтного парка.
Тут понятно, что не все садоводы признали свои ошибки и пеняли на саженцы и сорта. Тогда чтобы разговаривать с ними предметно, а не в теории, мы решили провести эксперимент. Взяли шесть одинаковых саженца голубики одного сорта и посадили их разными способами. Этот эксперимент мы заложили весной 2016 года, выращивали голубику в течение трех сезонов и в этой статье представляем вам результаты нашего эксперимента. И вам будет наглядно видно, как делать посадки голубики и ухаживать за нею.
Итак, весна 2016 года. В двух грядках выбрали грунт и под пять саженцев засыпали кислый торф в большом количестве, под один саженец насыпали обычную землю с садового участка.
В итоге: первый саженец рос в обычной садовой земле, второй в кислом торфе с добавлением органики, третий в чистом кислом торфе без добавок, четвертый в торфе с периодическим поливом гранулированным конским навозом, пятый в торфе с закислителем, шестой в торфе с закислителем и периодическим поливом биопрепаратом «Сияние».
Посадка была сделана 15 июня.
В течение сезона саженцы росли, особой разницы межу ними не было.
На фото ниже видно, что кусты примерно одинаковые.
Но вот весной следующего года разница была уже видна. Хуже всего выглядел саженец в обычной земле,
Еще через 10 дней на голубике полностью распустились листья, только на саженце в земле их было очень мало.
На фото ниже видна разница между почвогрунтом и состоянием кустарников.
В конце июня мы для интереса замерили величину листьев. В земле листья достигали длину 2 см, в торфе 3-5 см, самые большие листья были на саженце с поливом конским навозом.
В конце августа даже самым скептически настроенным садоводам было видно, что для голубики обычная почва противопоказана. Её нужно выращивать в кислом торфе.
На зиму над кустами поставили дуги (кладочная сетка) и закрыли геотекстилем марки «Д». Укрытие сняли после полного распускания листьев.
Начался третий сезон нашего эксперимента.
В начале июня на третий год после посадки голубика в первые была с цветами. Больше всего цветов было на растении в кислом торфе и с применением закислителя и препаратов «Сияние». Мы начали готовить емкости большого размера под урожай.
Но в июле нас ожидало очень большое разочарование. Мы уехали на десять дней в отпуск и по приезду обнаружили вот такую вот леденящую картину.
Произошло следующее. Голубика росла в грядках возле забора из профнастила. Около трех недель была жаркая погода, профнастил нагревался и высушивал листья голубики, а заодно и торф. В итоге листва сильно подгорела.
В первой грядке был особо большой урон.
Самое интересное и наглядное — голубика в чистом кислом торфе была самая целая, практически без подгоревших листьев! Другие кусты представляли собой жалкое зрелище.
Но за неделю листья еще сильнее подгорели.
В конце июня, когда жара прошла, мы сподобились провести замеры температуры. В тени температура составила 21 градус, а возле профнастила + 38 градусов тепла выше нуля! Жаль, что не замерили эту температуру в день, когда в тени было +33.
В середине августа уже можно было подвести итоги сезона. Лучше всех жару перенес куст, который рос в чистом кислом торфе на второй линии от забора из профнастила. На первой линии более-менее выглядел куст, который поливали конским навозом. По всей видимости навоз в торфе накапливал в себе влагу и поэтому голубика смогла перенести жарки период. На всех остальных кустах листва была подсохшей, а куст в обычной почве высох совсем.
На первой линии более-менее выглядел куст, который поливали конским навозом. По всей видимости навоз в торфе накапливал в себе влагу и поэтому голубика смогла перенести жарки период. На всех остальных кустах листва была подсохшей, а куст в обычной почве высох совсем.
Несмотря на всю жесть нашего эксперимента ягоды мы все-таки поели на двух кустах, хотя размером они были в три раза меньше, чем нужно.
1. Видовая почва для голубики это кислый торф. Оно и понятно, голубика болотная ягода, растущая в торфяниках. По опыту других садоводов, которые также экспериментировали с этой культурой, ежегодно торф нужно подкислять коллоидной серой. Без этого урожайность начинает сильно уменьшаться.
Если хотите чтобы ваша голубика заваливала вас сладкими ягодами — садите её в кислый торф.
2. Торф должен быть постоянно во влажном состоянии! Он плохо впитывает влагу и быстро высыхает. То есть голубике нужны частые и обильные поливы. Либо периодически бросайте под куст шланг и включайте воду, или положите ленту капельного полива. Еще хороший вариант — в кислый торф добавить вермикулит (электрической сушки). Он хорошо впитывает влагу и долго в себе сохраняет.
То есть голубике нужны частые и обильные поливы. Либо периодически бросайте под куст шланг и включайте воду, или положите ленту капельного полива. Еще хороший вариант — в кислый торф добавить вермикулит (электрической сушки). Он хорошо впитывает влагу и долго в себе сохраняет.
3. Не садите голубику возле железных заборов.
Еще раз для закрепления материала — голубика болотная ягода, растущая на кислом торфе во влажной среде. Поэтому садите её в кислый торф и обильно проливайте его водой.
P.S. Некоторое время назад один знакомых садовод, сторонник природного земледелия, рассказал о еще одном способе посадки голубики. Мы решили весной 2019 года заложить еще один большой эксперимент по голубике с разными способами посадки и ухода. Результатами эксперимента поделимся с вами в конце 2020 года.
Саженцы голубики, кислый торф и коллоидную серу для закисления вы можете приобрести в садовом центре «Сияние» в вашем городе.
Выращивание голубики садовой. Подготовка почвы для посадки голубики высокорослой.
Голубика высокорослая очень требовательна к почве, и именно это служит серьезным препятствием для ее распространения на территории Украины. Но это не пугает садоводов-любителей и фермеров, которые с каждым годом все больше познают эту культуру.
Лучше голубика садовая растет на легких суглинистых или песчано-суглинистых, хорошо аэрированных, прогреваемых и кислых почвах с содержанием гумуса не меньше 3,5 %. Оптимальные же условия для растений создаются только в том случае, если содержание органических веществ в почве составляет от 8,0 % и до 20%. Тонкая мочковатая волокнообразная корневая система голубики на 70% содержится в верхнем легком пористом грунте толщиной 30см.
Корни растения не могут проникать в глинистые тяжелые почвы, поэтому голубика предпочитает почвы, содержащие большие пропорции песка. Итак, в тяжелых почвах, насыщенных глиной, развитие корневой системы голубики будет ограниченным и замедленным.
Почвы со слишком низким уровнем грунтовых вод непригодны для выращивания голубики высокорослой. Чем более богата почва гумусом и чем выше ее влагоемкость, тем ниже может быть уровень грунтовых вод (60-80 см). При значительном его понижении обязателен полив. Однако голубика садовая не переносит затопления, особенно в разгар вегетации; при затоплении длительностью более 24 ч на растениях появляются признаки повреждений, их рост прекращается (в таком случае нужно незамедлительно прокапывать водосточные каналы с самой верхней точки затопленного участка к нижней).
На участках с плохим дренажем почвы (на тяжелых и средне тяжелых почвах) формируют поднятую гряду, а также на холмах с наклоном более 6%. Формирование поднятых рядов способствует менее глубокому проникновению корней растения в почву и предотвращает переувлажнению корневой системы голубики. Поднятие строк осуществляется на высоту 20 — 30 см, их ширина должна быть в пределах 1,0-1,2 м. Расстояние между рядами должно быть в пределах 3 метров.
Обычно ряды ориентируют с севера на юг, в таких условиях будет осуществляться максимальное освещение кустов солнцем. На склонах ряды пытаются ориентировать под 45 градусов к склону так, чтобы дождевые осадки не задерживались и свободно стекали вниз, не размывая гряду.
Там, где подземные воды находятся глубоко от поверхности, то смысла делать насыпные ряды нет. Сажают голубику высокорослую в траншеи шириной 1,0-1,2м и глубиной 40см с необходимым субстратом. Если кол-ва посадок небольшие, тогда можно сажать в ямы диаметром 1м и глубиной 30-40см. При этом стенки посадочной ямы посыпают серой.
Идеальной средой для выращивания голубики высокорослой является верховой торф с песком. Торф имеет нужную кислотность 3,5-4,5 рН и отвечает всем механическим свойствам, требуемым для данной культуры.
Если в Вашей местности проблема с торфом, можно использовать такие смеси субстрата:
— покупной верховой торф + земля с участка 1:1
— покупной верховой торф + земля с участка + опилки 1:1:1
— сосновый опад + песок + опилки 1:1:1
— сосновый опад + опилки 1:1
— опилки + земля с участка 1:1
ГЛАВНОЕ! Вам нужно создать такую среду для корневой системы, чтобы она содержала органику
(20%), была воздухо- и водопроницаемой, имела кислотность 3,5-4,5 рН.
Для закисления почвы используйте коллоидную или порошковую серу, уксус, яблочную или щавелевую кислоту.
Опилки, стружку или кору желательно использовать хвойных пород. Они изначально имеют кислую среду, которая так необходима грибам и бактериям, живущим в симбиозе с растением. Но можно и другие.
Опилки мелкой фракции (от ленточной пилорамы) в использовании не желательны, т.к. спрессовываются в субстрате и плохо пропускают воздух, воду!
Такая разная голубика
Голубикой принято называть голубику обыкновенную, повсеместно встречающуюся в Северном полушарии. Также ее называют голубикой низкой или болотной. Высокорослая голубика − родом из Северной Америки, ее выращивают как плодовую и иногда как декоративную культуру. Оба этих вида относятся к семейству вересковых, к которому относятся также брусника, клюква и черника.
У всех их представителей одна важная особенность: они растут только на кислой почве. Все из-за особого гриба, растущего на кислой почве. Он вступает в симбиоз с корнями вересковых и поставляет им воду и питательные вещества. Сами вересковые корневых волосков не имеют и поэтому на нейтральных и щелочных почвах чахнут и погибают.
Он вступает в симбиоз с корнями вересковых и поставляет им воду и питательные вещества. Сами вересковые корневых волосков не имеют и поэтому на нейтральных и щелочных почвах чахнут и погибают.
Справка от «Хозяйства»
Иногда голубику называют пьяникой или гонобобелем. Так ее прозвали за то, что она пьянит и вызывает головную боль. Виновник в этом на самом деле багульник, который часто растет по соседству с голубикой.
У нас в стране произрастает только один вид голубики – обыкновенная. В Канаде и США несколько видов, но селекционеры обратили внимание на голубику высокорослую. И вывели аж 45 ее сортов. В последнее время они стали проникать и в нашу страну, вызвав настоящий фурор.
Считается, что культурные сорта − не такие полезные, как дикорастущие. На самом деле это не так. В культурных сортах голубики высокорослой содержится больше витаминов, у плодов красивый и приятный вид, размеры значительно выше, у них приятный вкус и неплохой урожай – до 2,5 кг с куста.
Началось все девяносто лет назад. Тогда из дикорастущих зарослей голубики высокорослой отобрали сорт Брукс. На следующий год из голубики низкой получили сорт Рассел. Скрестив их, получили интересные результаты. В результате отобрали сорта: Пионер, Кэботи, Катарина, Рубель.
В наше стране в условиях Подмосковья самыми перспективными считаются до сих пор Дикси, Джерси, Ранкокас, Уэймут. Они каждый год плодоносят и дают плоды высокого качества. Величина ягод достигает размеров мелкоплодной вишни.
Только не надо раньше времени расстраиваться. Дело в том, что первые годы кусты дают лишь немного мелких ягод, и только на 3-4 год жизни плодоносят как следует.
Лучшая почва для голубики – кислая, торфяно-песчаная… Если ее посадить в тяжелую глинистую почву, то нормальных урожаев точно не будет. Однако садоводы выращивают голубику даже на Юге. Просто роют крупные ямы, заменяя почву на смесь торфа и песка и регулярно подкисляя ее аккумуляторной кислотой или уксусной эссенцией.
Главное все же для садовой голубики — наличие кислой почвы (рН в пределах 3,8-5). О благоприятных почвенных условиях можно судить по растениям-индикаторам, таким, как хвощ, щавель, мята. Даже при рН около 6 голубика растет медленно, не говоря уже о нейтральной, а тем более щелочной почве.
В остальном эта культура не требовательна к плодородию почвы, подкормкам и даже не требует защитных обработок. Единственное: она не любит сорняков и положительно реагирует на поливы. Без воды вообще урожай не получить. И в южных районах с этим сталкиваются. Там из-за жары часто урожаи получают небольшие. Исправить положение помогает мульча почвы опилками или соломой.
Подписывайтесь на нашу группу в Одноклассниках
Голубика высокорослая | Институт леса
ГОЛУБИКА ВЫСОКОРОСЛАЯ (Vaccinium covilianum L.) – листопадное растение семейства брусничные (род вересковые) является представителем группы североамериканских видов, общим признаком которых являются высокорослость: высота ее кустов достигает 3-5 м. два вида из этой группы – голубика щитковая и голубика южная окультурены в США в начале ХХ века и положили начало большинству промышленных сортов (в настоящее время более 130 сортов).
два вида из этой группы – голубика щитковая и голубика южная окультурены в США в начале ХХ века и положили начало большинству промышленных сортов (в настоящее время более 130 сортов).
В Северной Америке (США и Канада) плантации голубики высокорослой занимают около 30 тыс. га. Посадки этой культуры появились в Германии, Голландии, Австрии, Польше, Франции, Португалии, Испании, Японии, Чили, Новой Зеландии и Австралии. В Беларуси голубику высокорослую возделывают в небольших объемах (около 50 га).
Большинство культурных сортов высокорослой голубики имеют высоту куста от 1,2 до 2,5 м. ягоды крупные (1,5-2,5 см в диаметре), по вкусу кисло-сладкие, очень ароматные, собраны в плодовые кисти по 5-8 и более штук. Созревают неодновременно (порциально), в Беларуси в период с первой декады июля до второй декады сентября.
Урожаи ягод голубики высокой достигают 5-10 и более тонн с 1 га (с куста старше 6 лет можно получить от 5 до 10 кг ягод). Куст голубики на одном месте может расти и плодоносить не менее 30 лет.
Голубика высокорослая – весьма ценное пищевое и лекарственное растение. Ягоды ее богаты органическими кислотами, фенольными соединениями, которые выполняют важные физиологические функции в организме человека. Они уменьшают проницаемость и повышают прочность кровеносных капилляров, способствуют усвоению витамина С, участвуют в окислительно-восстановительных реакциях, регулируют работу желез внутренней секреции. Флавоноиды обладают сосудорасширяющим, противосклеротическим, противовоспалительным, противоопухолевым и радиозащитным действием. Фенолкислоты (хлорогеновая, кофейная и др.) проявляют желчегонное, мочегонное, капилляроукрепляющее действие.
Как все сочные плоды, ягоды голубики высокорослой являются диетическим продуктом (не вызывают аллергии даже у ребенка). В сравнении с черникой, с которой они очень схожи по вкусу и цвету, ягоды голубики содержат в 2 раза больше сахаров, но несколько меньше минеральных солей и витамина С. Поскольку в них содержится мало натрия, много калия и пектинов, голубичная диета прекрасно выводит из организма шлаги, в т. ч. радиоактивного происхождения. Голубика может быть рекомендована для водителей автомашин в качестве отличного средства против куриной слепоты. Благодаря высокому содержанию фруктового сахара, ягоды хорошо усваиваются диабетиками. «Если вы будете выращивать голубику, то уже никогда не умрете». Так говорят американцы. И они близки к истине. Ее ягоды не только тормозят процессы старения, но и омолаживают организм. Своеобразный эликсир молодости!
ч. радиоактивного происхождения. Голубика может быть рекомендована для водителей автомашин в качестве отличного средства против куриной слепоты. Благодаря высокому содержанию фруктового сахара, ягоды хорошо усваиваются диабетиками. «Если вы будете выращивать голубику, то уже никогда не умрете». Так говорят американцы. И они близки к истине. Ее ягоды не только тормозят процессы старения, но и омолаживают организм. Своеобразный эликсир молодости!
Поэтому не зря голубику высокую средства массовой информации все чаще называют «ягодой ХХI века».
Голубика высокая является уроженкой болот, достаточно неприхотлива к условиям произрастания, но чтобы ваша работа не оказалась напрасной при ее выращивании необходимо руководствоваться следующими требованиями.
ПОДБОР УЧАСТКА И ПОДГОТОВКА ПЛОЩАДИ (ПОЧВЫ). Для голубики высокорослой предпочтительны ровные или умеренно наклонные, хорошо прогреваемые, с полным солнечным освещением и достаточной циркуляцией воздуха участки. Растения голубики успешно растут и плодоносят на легких (песчаных и супесчаных) и кислых (торфяных и торфяно-болотных верхового и переходного типов) хорошо аэрированных почвах. Содержание гумуса в минеральных почвах должно составлять не менее 3,5%. Исключительно важна постоянная умеренная влажность почвы, особенно в период вегетации, поскольку голубика высокая – влаголюбивое растение. Почвы со слишком низким уровнем грунтовых вод можно использовать только при обязательном поливе. Корневая система ее расположена в основном в верхнем 15-20-сантиметровом слое почвы, который наиболее подвержен иссушениюХорошие результаты дает капельный полив. оптимальные условия водообеспечения растений голубики создаются в том случае, если грунтовые воды находятся на глубине 40-60 см. но голубика высокая не переносит и избыточного увлажнения, особенно длительного затопления в период вегетации.
Содержание гумуса в минеральных почвах должно составлять не менее 3,5%. Исключительно важна постоянная умеренная влажность почвы, особенно в период вегетации, поскольку голубика высокая – влаголюбивое растение. Почвы со слишком низким уровнем грунтовых вод можно использовать только при обязательном поливе. Корневая система ее расположена в основном в верхнем 15-20-сантиметровом слое почвы, который наиболее подвержен иссушениюХорошие результаты дает капельный полив. оптимальные условия водообеспечения растений голубики создаются в том случае, если грунтовые воды находятся на глубине 40-60 см. но голубика высокая не переносит и избыточного увлажнения, особенно длительного затопления в период вегетации.
Одно из важнейших условий, обеспечивающих успех культуры голубики высокой – это реакция почвы. Она должна быть кислой с рНKCl пределах 3-5 (чем кислей, тем лучше). Кислотность почвы можно определить по растениям индикаторам. На минеральной почве с кислой средой чаще всего встречаются вереск, хвощ, щавелек, пикульник, мята, торица, вероника; на кислых торфяно-болотных почвах – сфагновые мхи, пушица, подбел, багульник, голубика топяная.
Но если на вашем участке почва не отличается высокой кислотностью, ее придется искусственно закислить. Для этого потребуется кислый торф или сера. Торф перемешивают с почвой в соотношении 1:1 на глубину до 40 см. серу рассеивают за год до посадки по всей поверхности почвы, а затем заделывают на глубину до 15 см.на песчаных почвах с рНKCl 5,0 достаточно 5 кг на 100кв. м; при рНKCl 6,0 дозу увеличивают в двое.
Наиболее простой и наименее затратный способ создания необходимых условий для выращивания голубики высокорослой на почвах, не отличающихся высокой кислотностью, является создание так называемых «колодцев» на хорошо освещенных участках. Для этого выкапывается яма глубиной 40-50 см и диаметром 0,8-1,0 м, которая заполняется верховым нераскисленным торфом. При его отсутствии яма заполняется субстратом, состоящим на 50% из верхнего наиболее плодородного слоя выкопанной почвы, 40-50% опада хвои с подстилкой из соснового леса (можно и из елового) и 5-10% сосновой коры (или опилок). При возможности добавьте в этот субстрат 40-60 г серы. Хвоя хорошо закисляет почву и создает условия для развития микоризы; кора сосны (опилки) не дает уплотняться субстрату, что оптимизирует водно-воздушный режим корнеобитаемой зоны.
Перед посадкой растений приготовленную грядку или «колодец» следует полить подкисленной водой: 10л на 1 кв. м. Для этого подойдет любая кислота. Лимонную или щавелевую нужно развести из расчета 1 ч.л. на 10 л воды, уксусную и яблочную (9-процентную) – в соотношении 100г на 10 литров.
ПОСАДКА. Голубику высокорослую высаживают 2-3-летними саженцами осенью или весной. Весенняя посадка предпочтительнее. В случае, если используется посадочный материал с закрытой корневой системой (в контейнерах), посадку растений можно производить в любое время вегетативного периода, освободив кустики от контейнера. Расстояние между посадочными местами не менее 1,5 м, между рядами – 3 м. Для рационального использования освещения ряды ориентируют с севера на юг. В случае если посадки создаются на участке, где уже ранее были высажены плодово-ягодные растения, желательно кустики голубики высаживать на расстоянии от них не ближе 3-х метров (во избежание нежелательной конкуренции, прежде всего за влагу и свет). Расстояние от плодово-ягодных деревьев должно быть еще большим (5 м).
Расстояние от плодово-ягодных деревьев должно быть еще большим (5 м).
Поверхность почвы вокруг куста целесообразно замульчировать слоем сосновых опилок 8-10 см. мульча создает благоприятный температурный режим, способствует сохранению влаги в почве, а также препятствует развитию сорняков. Кроме того, в процессе разложения опилок происходит подкисление почвенного субстрата под растениями.
УХОД ЗА РАСТЕНИЯМИ. В первые годы после посадки уход за растениями заключается, главным образом, в регулярных поливах и прополке. Обрабатывать почву вокруг растений следует очень осторожно, на глубину не более 5 см, так как 90% корней голубики находится в верхнем 15-сантиметровом слое почвы. Лучшим способом ухода за посадками является ежегодное осеннее мульчирование приствольных кругов опилками хвойных пород слоем не более 2-3 см.
Необходимо следить за тем, чтобы верхний слой почвы постоянно находился во влажном состоянии. Поэтому не реже 2-х раз в неделю растения необходимо полевать: по ведру (10 л) на взрослы куст. Вода, которая используется для полива должна быть кислой (рН от 4 до 5), однако в большинстве случаев рН воды выше. Поэтому нейтральные и щелочные воды желательно подкислять (названия используемых для этой цели кислот и концентрации растворов приведены выше). Полив кустов кислой водой достаточно производить один раз в месяц.
Вода, которая используется для полива должна быть кислой (рН от 4 до 5), однако в большинстве случаев рН воды выше. Поэтому нейтральные и щелочные воды желательно подкислять (названия используемых для этой цели кислот и концентрации растворов приведены выше). Полив кустов кислой водой достаточно производить один раз в месяц.
Очень важно обеспечить хороший полив растений в августе, когда голубика плодоносит и одновременно закладывает цветковые почки будущего урожая.
Голубика высокая ежегодно нуждается в больших дозах азотных удобрений и в меньших – фосфорных и калийных. При недостатке азота желтеют листья, мельчают ягоды, слабо растут побеги. При посадке в весеннее время вносят 35-40 г сульфата аммония под растение. Чтобы получить хороший урожай в последующие годы количество азотного удобрения увеличивают в соответствии с годовым ростом растения (примерно в 2 раза). Вместо сульфата аммония можно использовать аммиачную селитру (25-30 г/куст).
Азот вносится в три этапа: 50% — в период распускания почек (со всей нормой фосфора и калия), 30% — в начале мая и 20% в начале июня.
Фосфор вносят в форме простого (50-60 г на растение) или двойного (25-30 г на растение) суперфосфата с заделкой на глубину 5-10 см.
Калий вносят в форме сульфата калия (хлористый калий токсичен для растений) в дозе от 30 до 40 г на куст.
Подкормки фосфорными и калийными удобрениями проводят в 2 приема: первый – рано весной перед началом роста (вносят 2/3 всей дозы), второй – в июне (вносят 1/3 дозы).
На очень кислых песчаных или торфяных почвах может периодически проявляется недостаток меди. Устраняют его опрыскиванием растений в период вегетации 0,1% раствором сернокислой меди.
Не следует подкармливать голубику органикой – навозом, компостом, куриным пометом. Почва защелачивается и растения погибают.
Одним из основных мероприятий по уходу за растениями голубики высокой является их обрезка. При отсутствии обрезки ухудшается рост растений и снижается число закладываемых цветочных почек, ягоды мельчают, урожай падает. Обрезка способствует более раннему цветению, уменьшает повреждения зимой.
Старые побеги должны постоянно (ежегодно) заменяться новыми. Омолаживать следует уже 3-4-летние кусты. Обрезают голубику ранней весной перед набуханием почек, или осенью после листопада. Удаляют, прежде всего, усыхающие, больные, поврежденные, а также лежащие на земле ветви. Затем вырезают старые ветви и верхние части ветвей, не дающие сильных приростов, и удаляют тонкие, загущающие центр куста разветвленные побеги, даже если на них есть многочисленные цветковые почки. Должно оставаться как минимум 3-5 самых молодых (однолетних) побегов, отходящих от основания куста.
Потребность в сильной омолаживающей обрезке возникает только после 15-20-летней эксплуатации растений.
На зиму растения следует обработать медьсодержащими препаратами: хлорокисью меди, купрозаном.
Это невероятно, но факт!
Голубика в Калуге, оказывается, может регулярно и обильно плодоносить.
Не раз убеждалась, что в нашем регионе есть место феноменам, будь то уникальные личности или удивительные явления. И вот недавно мне посчастливилось встретить сразу и то, и другое: сумасшедший, обсыпной урожай голубики на участке под Калугой, который принадлежит замечательному, опытнейшему питомниководу, садоводу Николаю Северину.
И вот недавно мне посчастливилось встретить сразу и то, и другое: сумасшедший, обсыпной урожай голубики на участке под Калугой, который принадлежит замечательному, опытнейшему питомниководу, садоводу Николаю Северину.
Даже сейчас, в середине августа, многие кусты усыпаны ягодой, хотя основной урожай, конечно, уже снят. Часть урожая автор-консультант «вестинского» приложения «Кто в доме хозяин» Северин постарался сохранить до моего приезда из отпуска (даже зонтом притенял некоторые кусты), чтобы через нашу газету люди убедились не только в том, что голубика может у нас расти, но и что она способна давать регулярные и обильные урожаи крупнейших и вкусных ягод. И это не реклама — как питомниковод Николай Николаевич не занимается распространением голубики, это гордость исследователя и трудяги, а главное — призыв к землякам не бояться трудностей выращивания фантастически целебной ягоды.
Как было сказано, посадочный материал голубики на продажу Северин не выращивает, однако по моей просьбе порекомендовал калужанам испытанный на своем опыте материал белорусов, постоянных участников ярмарок в Анненках — КФХ «Ягодка», что под Минском. А в качестве единственной настольной книги для тех, кто возьмется выращивать эту ягоду, он советует исследование белорусского же ученого Татьяны Курлович «Брусника, голубика, клюква, черника» (кстати, я посмотрела: книгу можно найти в Интернете).
А в качестве единственной настольной книги для тех, кто возьмется выращивать эту ягоду, он советует исследование белорусского же ученого Татьяны Курлович «Брусника, голубика, клюква, черника» (кстати, я посмотрела: книгу можно найти в Интернете).
Экскурсия
Первое, что довелось увидеть, — ямы-траншеи для будущей посадки плодовых культур. Вот уж четкий ответ всем тем, кто предполагает, что у Северина вся удача основана на хорошей почве: почва на стенках и дне траншей – самая что ни на есть отвратительная, глина, камни и песок! Другое дело, что ямы хозяин заполняет всем необходимым для плодородия почвы. И это адский труд, ведь компоненты пригодной для роста почвенной смеси никто не подает на блюдечке с голубой каемочкой. Перегной он берет из-под лиственных деревьев, опилки возил с бывшего комбината СДВ, и так далее и тому подобное. Все это километры пешком по пересеченной местности, с тележкой и мешками.
Сад Северины приобрели в 1981 году. Здесь была масса хаотически расположенных плодовых деревьев, которые пришлось корчевать. Покупая участок, Николай Николаевич намеревался заниматься клубникой и смородиной, но однажды после всех трудов богатый урожай клубники у него просто-напросто украли – сняли все до единой ягоды, и желание растаяло. Но увлечение смородиной осталось. Сейчас он выращивает на саженцы смородину всех видов – белую, розовую, розово-черную, красную, черную.
Покупая участок, Николай Николаевич намеревался заниматься клубникой и смородиной, но однажды после всех трудов богатый урожай клубники у него просто-напросто украли – сняли все до единой ягоды, и желание растаяло. Но увлечение смородиной осталось. Сейчас он выращивает на саженцы смородину всех видов – белую, розовую, розово-черную, красную, черную.
Есть здесь прекрасные экземпляры малины разных видов, сортов и цветовой палитры, крыжовник красноплодный бесшипный, груша, орешник… Однако главное увлечение последних десяти лет – это голубика. Сейчас на участке 101 куст 11 сортов, но свой профессиональный интерес исследователя Северин собирается ограничить 70 кустами.
«Ешь чернику вёдрами!»
— Первым, кто у нас занимался голубикой, был Владимир Александрович Грознов, — рассказывает Николай Николаевич. — Ветеран войны, он приходил к нам в школу, делился фронтовыми воспоминаниями. А второй раз я встретил его уже позже, в клубе садоводов, он рассказывал о голубике. У меня такой склад мозгов, что все услышанное или увиденное там хранится десятилетиями, а когда это необходимо, выходит на первый план.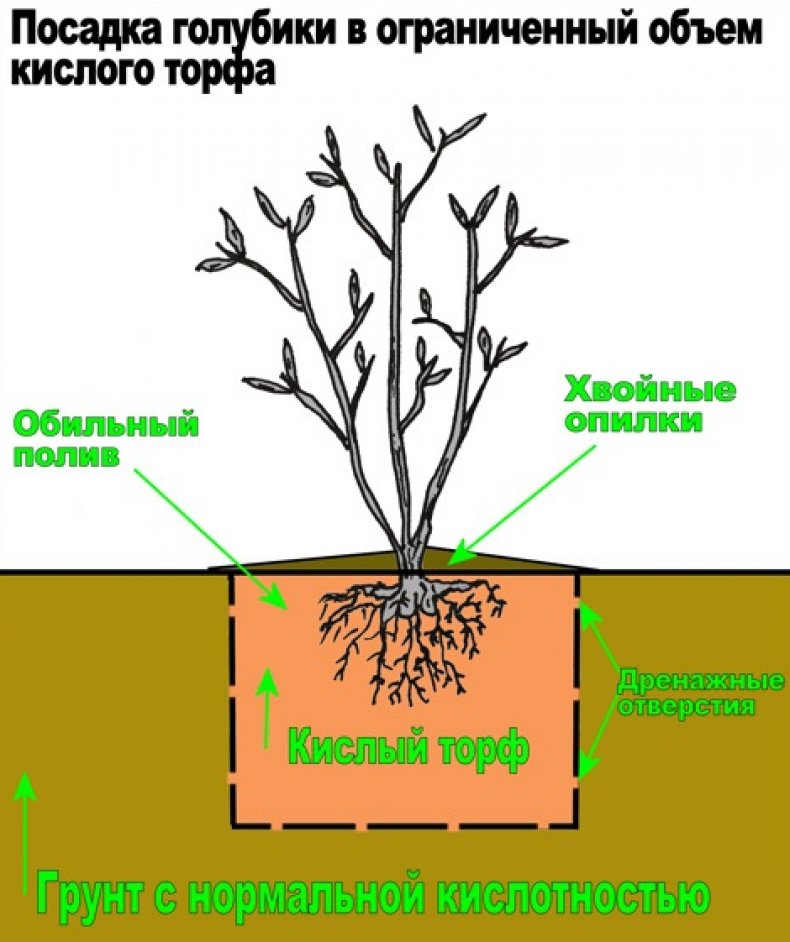 Вот и его одержимость голубикой вспомнилась спустя много лет…
Вот и его одержимость голубикой вспомнилась спустя много лет…
Один академик, друг нашего героя, однажды привез ему из Москвы несколько кустов, которые Северин разместил в самом низу участка (участок, кстати, наклонный, почти отвесный), подняв уровень почвы на 1,5 метра. Голубика прекрасно росла, давала побеги, а весной… почти вся погибла. Это произошло потому, что к этой части участка стекал весь холодный воздух, там скапливалась сырость. Тогда Николай Николаевич и переместил их наверх, где теперь голубики целая плантация.
— Когда выкапывал те кусты, понял то, о чем пишет Курлович, – рассказывает Северин. — Корни необходимо разминать, разбирать каждый по отдельности перед посадкой. У моих же выкопанных кустов корни как были переплетены в комок, так и остались, без движения, а рост давали корни, новый ярус которых кусты образовали в результате окучивания.
И вот Северин посадил голубику по всем правилам. К этому времени возникла необходимость увеличить количество этого лекарственного растения. .. Если помните, в конце прошлого столетия в печати все время велись ярые баталии: так ли уж полезны и чудодейственны ягоды черники или это инсинуации? Но когда у Николая Николаевича начались серьезные проблемы со здоровьем, с глазами, московский врач сказала категорично: «Никого не слушай, ешь чернику ведрами!» Так он и поступает до сих пор, выращивая обильные урожаи голубики, которая по свойствам идентична чернике. Сортовой состав пополнил у белорусов, чей посадочный материал к тому времени стал появляться на наших ярмарках.
.. Если помните, в конце прошлого столетия в печати все время велись ярые баталии: так ли уж полезны и чудодейственны ягоды черники или это инсинуации? Но когда у Николая Николаевича начались серьезные проблемы со здоровьем, с глазами, московский врач сказала категорично: «Никого не слушай, ешь чернику ведрами!» Так он и поступает до сих пор, выращивая обильные урожаи голубики, которая по свойствам идентична чернике. Сортовой состав пополнил у белорусов, чей посадочный материал к тому времени стал появляться на наших ярмарках.
Несекретные материалы
Премудростей при выращивании голубики хватает, говорит Николай Николаевич, но если следовать правилам, то результат обязательно будет. И разные варианты для его достижения тоже можно найти. Например, для роста голубики обязательна кислая почва, и если нет возможности вносить кислый торф, то можно подкислять почву раствором аккумуляторного электролита, как это делает Северин. Ну и так далее, опять же читайте Курлович.
У высокорослой голубики высота куста может достигать двух метров и более. Сорта различаются сроком созревания и – немного – размерами и формой. Форма бывает приплюснутая и округлая, даже чуть вытянутая. А размеры – смотрите на фото – достигают 10-рублевой монеты.
Сорта различаются сроком созревания и – немного – размерами и формой. Форма бывает приплюснутая и округлая, даже чуть вытянутая. А размеры – смотрите на фото – достигают 10-рублевой монеты.
Урожаи обильные, но среднее количество с куста Николай Николаевич не подсчитывал, потому что ягоды созревают неравномерно. Мы с ним попытались заняться приблизительными подсчетами на примере небольшого кустика сорта Нордланд: в начале плодоношения был собран литр, потом два, потом еще литр, а ягода продолжает спеть… Окончательные объемы урожая до сих пор под вопросом. И самое главное при такой урожайности то, что ягоды осыпаются лишь тогда, когда уже совсем-совсем переспели, поэтому можно не опасаться «проворонить» оптимальные сроки сбора.
У этой вкусной, сладкой, сочной и красивой сизо-голубой ягоды очень много целебных качеств. Не только плоды, но и листья растения применяются как в народной, так и в официальной медицине для профилактики и лечения самых разных, в том числе и редких, заболеваний. У ягоды эксклюзивный витаминный и минеральный состав. Очень ценно и то, что замороженная голубика после разморозки остается точно такой же, как свежая, и по внешнему виду, и по составу полезных веществ.
У ягоды эксклюзивный витаминный и минеральный состав. Очень ценно и то, что замороженная голубика после разморозки остается точно такой же, как свежая, и по внешнему виду, и по составу полезных веществ.
И еще одна ипостась есть у этого чудесного растения. Оно очень декоративно, способно украсить любой участок и радовать человека своей прелестью почти круглый год: весной — цветами, летом — обсыпным синим урожаем, а осенью — полыхающей яркими рубинами листвой…
Татьяна МЫШОВА.
Фото автора.
Лучшая уже смешанная почва для черники | Главная Руководства
Автор: Кэти Хабас Обновлено 30 ноября 2020 г.
Растения голубики (Vaccinium spp.) могут десятилетиями расти в зонах 3–10 USDA (в зависимости от вида) при идеальном уходе и условиях выращивания. В частности, почва для черники должна быть кислой. Поскольку большинство почв в Соединенных Штатах не являются естественными кислыми, вам нужно научиться готовить черничную грядку с подкислителем почвы. Или вы можете добавить лучшую почвенную смесь для черники на место посадки, чтобы получить простое и быстрое решение.
Или вы можете добавить лучшую почвенную смесь для черники на место посадки, чтобы получить простое и быстрое решение.
Черника Требования к почве и росту
Черника также требует полного солнца и хорошо дренированной, но постоянно влажной почвы для оптимальной производительности. Как и большинство растений, чернику также следует сажать в богатую почву с хорошо выдержанным компостом для постоянного снабжения питательными веществами. Университет штата Мэн рекомендует один раз в год весной вносить либо сбалансированное удобрение NPK, либо удобрение на основе сульфата аммония. Они опубликовали полезную таблицу, которая поможет вам вносить правильное количество удобрений в зависимости от возраста вашего куста черники.
По данным Университета Миннесоты, голубике требуется pH почвы от 4,0 до 5,5, но Miracle-Gro предполагает, что голубика лучше всего себя чувствует в гораздо более узком диапазоне: от 4,5 до 4,8. Она намного более кислая, чем большинство садовых почв, поэтому перед посадкой черники внесите в нее изменения. Проверяйте почву каждые шесть месяцев и вносите соответствующие изменения, чтобы ваши растения черники были в хорошем состоянии.
Проверяйте почву каждые шесть месяцев и вносите соответствующие изменения, чтобы ваши растения черники были в хорошем состоянии.
Добавьте слой мульчи вокруг основания черники, чтобы помочь почве удерживать влагу.Мульча также будет медленно добавлять питательные вещества в почву по мере ее разложения. Рассмотрите возможность использования сосновой соломы в качестве мульчи, чтобы со временем повысить кислотность почвы.
Поправки к кислотной почве для черники
Ваш выбор подкислителя почвы зависит от того, есть ли у вас уже растения черники в земле. Если вы в настоящее время планируете сад на следующий год, у вас есть время добавить элементарную серу в будущую черничную грядку. Сера не сразу подкисляет почву, поэтому лучше внести ее в почву за несколько месяцев до посадки куста черники.
Если вы готовы посадить чернику прямо сейчас, используйте торфяной мох сфагнум. Прежде чем начать, проверьте рН исходной почвы. Если он находится между 5,5 и 7,0, насыпьте от 4 до 6 дюймов торфяного мха на верхние 6–8 дюймов грядки черники. Если рН выше 7,0, требуется более 6 дюймов торфяного мха сфагнума. Университет Миннесоты отмечает, что добыча сфагнового торфяного мха вредна для окружающей среды, и рекомендует по возможности использовать серу.
Если он находится между 5,5 и 7,0, насыпьте от 4 до 6 дюймов торфяного мха на верхние 6–8 дюймов грядки черники. Если рН выше 7,0, требуется более 6 дюймов торфяного мха сфагнума. Университет Миннесоты отмечает, что добыча сфагнового торфяного мха вредна для окружающей среды, и рекомендует по возможности использовать серу.
Поскольку у растений голубики неглубокая корневая система, которая распространяется больше наружу, чем вниз, внесите кислые удобрения в круг диаметром от 2 до 3 футов вокруг места посадки.
Лучшая почвенная смесь для черники
Использование уже перемешанной почвы — еще один вариант быстрого наращивания почвы на грядке для черники. Лучшие почвы в мешках для черники уже имеют кислый pH. Подходящие продукты могут упоминать чернику непосредственно на упаковке, или они могут перечислять другие растения, любящие кислоту, включая азалии (Rhododendron spp.), гортензии (Hydrangea macrophylla), камелии (Camellia japonica) или гардении (Gardenia jasminoides) в качестве подходящих видов.
Прежде чем купить уже смешанную почву, рекламируемую как кислая, найдите на упаковке гарантию pH. Некоторые бренды дают расплывчатые описания, говоря, что pH почвы «менее 7,0». Это может означать, что pH почвы составляет 6,5, что недостаточно для черники.
Хорошим брендом, на который стоит обратить внимание, является Dr. Earth Organic & Natural Acid Lovers Potting Mix. Производитель утверждает, что он обеспечивает рН почвы 5,5. Однако, если вы смешаете этот продукт с существующей почвой, общий уровень pH может увеличиться.Он также подходит для использования в контейнерах.
Проверка почвы перед посадкой голубики
Простой анализ почвы показывает, будет ли голубика плохо расти на новом месте или будет процветать.
Многие хотят посадить чернику. Я называю это черничной лихорадкой. Садоводы с удовольствием высаживают эти экзотические растения в своих садах. Люди, которые хотят заниматься выращиванием черники, думают, что смогут заработать большие деньги, если будут выращивать чернику. Мне звонят люди, собирающиеся сажать чернику, и спрашивают, что им нужно сделать, чтобы подготовить участок.Я всегда спрашиваю: «Какой pH почвы?» Ответ обычно «я не знаю» или «это важно?»
Мне звонят люди, собирающиеся сажать чернику, и спрашивают, что им нужно сделать, чтобы подготовить участок.Я всегда спрашиваю: «Какой pH почвы?» Ответ обычно «я не знаю» или «это важно?»
На мой взгляд, рН почвы является самым важным фактором при выборе участка для выращивания голубики. Если руководящая мантра в сфере недвижимости — это место, место и еще раз место, то с черникой это pH, pH, pH! Голубика требует кислых почв. Расширение Мичиганского государственного университета рекомендует, чтобы рН почвы был между 4,5 и 5,5. Если вы посадите чернику в нейтральную почву (pH почвы от 6,5 до 7), которую предпочитает большинство растений, растения будут желтыми и будут плохо расти, если вообще будут расти.
Железный хлороз часто возникает в результате посадки в почву с высоким pH.
Симптомы обычно проявляются на молодых листьях и побегах. Листья
желтые с зелеными жилками. Слабые верхушки побегов часто погибают к зиме.
Фото: Марк Лонгстрот, MSUE
Если вы хотите выращивать чернику, первое, что вы должны сделать, это проверить рН почвы на участке, чтобы убедиться, что почва достаточно кислая для выращивания черники. К сожалению, снижение рН почвы не является быстрым, дешевым или легким делом.Снижение рН почвы — медленный процесс, который может занять годы. Самый дешевый способ понизить рН почвы — это добавить серу в почву и подождать, пока почвенные бактерии не превратят серу в сульфат, чтобы снизить рН почвы. Этот процесс может занять несколько лет и требует сотни или тысячи фунтов серы на акр.
К сожалению, снижение рН почвы не является быстрым, дешевым или легким делом.Снижение рН почвы — медленный процесс, который может занять годы. Самый дешевый способ понизить рН почвы — это добавить серу в почву и подождать, пока почвенные бактерии не превратят серу в сульфат, чтобы снизить рН почвы. Этот процесс может занять несколько лет и требует сотни или тысячи фунтов серы на акр.
Изменить рН почвы намного проще и быстрее, если у вас еще нет посаженной черники. Если pH почвы выше 6 или почва тяжелая глинистая, я не думаю, что стоит пытаться изменить pH почвы для черники.Это просто требует слишком много времени, усилий и денег. Вам лучше найти другую ценную культуру, которая растет на вашем участке, чем тратить много времени и денег на переделку участка под чернику, в то время как у других людей есть хорошие участки черники, которые они могут посадить без особых усилий.
Существуют и другие более быстрые и менее экономичные способы изменения pH почвы. Вместо серы можно использовать сульфат железа, но его потребуется в восемь раз больше. Некоторые производители добавляют серную кислоту в воду для полива, но это не только опасно, но и дорого.Домовладельцы могут просто заменить почву для нескольких кустов, но это не очень практично для коммерческого производителя с 1452 кустами голубики, посаженными 3 фута на 10 футов на акре земли.
Голубика – многолетнее растение-долгожитель, и на создание посадки кустов голубики уходит несколько лет. Вы не должны ожидать сбора урожая в течение первых трех или четырех лет, пока вы выращиваете куст, и для того, чтобы поле достигло полного урожая, требуется от 10 до 12 лет. Первоначальные затраты в течение первых шести лет составляют от 15 000 до 20 000 долларов на акр.Затраты на выращивание составляют от 2000 до 3000 долларов в год. Первый шаг в посадке голубики – выяснить, сможете ли вы легко вырастить ее на своем участке. В противном случае они могут стать дорогой денежной ямой.
Для получения дополнительной информации см. информационный бюллетень «Снижение pH почвы с помощью серы» на веб-сайте Michigan Blueberry Facts.
Была ли эта статья полезной для вас?
Расскажите, почему
Представлять на рассмотрениеграниц | Анализ структуры сообщества в корне и почвенном микробиоме дикой голубики
Введение
Здоровье и развитие растений в значительной степени зависят от взаимодействия между хозяином и его микробиомом.Растения больше не считаются отдельными организмами, а скорее динамическими образованиями, включающими как растения, так и микробиоту со сложными взаимодействиями и функциями (Zilber-Rosenberg and Rosenberg, 2008; Vandenkoornhuyse et al., 2015). Пополнение микробиоты растений предполагает постепенное обогащение микробного сообщества почвы (сортировка видов) через несколько местообитаний в сторону определенного подмножества микроорганизмов, населяющих внутреннюю ткань растения, эндосферу (Vandenkoornhuyse et al. , 2015). Эти местообитания отличаются физической близостью к растению и уровнем влияния хозяина на микробные сообщества.Эти среды обитания, от наименее до наиболее близких, включают насыпную почву, ризосферу (тонкий слой почвы, окружающий корни), ризоплану (поверхность корневой ткани, заселенную микроорганизмами) и эндосферу.
, 2015). Эти местообитания отличаются физической близостью к растению и уровнем влияния хозяина на микробные сообщества.Эти среды обитания, от наименее до наиболее близких, включают насыпную почву, ризосферу (тонкий слой почвы, окружающий корни), ризоплану (поверхность корневой ткани, заселенную микроорганизмами) и эндосферу.
Почва является источником связанного с растениями микробиома, и хотя свойства почвы являются детерминантами корневого микробиома, растение-хозяин существенно влияет на формирование ризосферных и эндофитных микробных сообществ. По мере углубления понимания микробиома почвы и растений необходимо сместить фокус исследований с простого описания структуры сообщества на выявление основных механизмов, определяющих сложность микробиоты и связывающих всех членов почвенного сообщества в единую стабильную структуру. и функциональная сущность (Fierer, 2017; Shade, 2017).В результате взаимодействия микроб-микроб и микроб-хозяин в растительных микробиомах и их роль в формировании связанных с корнями микробных сообществ, а также потенциал этих взаимодействий для воздействия на здоровье хозяина стали предметом нескольких недавних исследований (Agler et al. al., 2016; Lareen et al., 2016; van Overbeek and Saikkonen, 2016; Busby et al., 2017; Yang et al., 2017; Zhang et al., 2017). Недавно была предложена и подтверждена роль некоторых микробных таксонов («хабовых» таксонов) в формировании микробиомов растений в ответ на абиотические факторы и факторы хозяина (Agler et al., 2016). Центральные таксоны были определены как микробные группы, которые значительно более связаны внутри сети, чем другие группы, на основе измерений центральности, таких как степень, центральность промежуточности и центральность близости. Сильные взаимодействия растений и микробов позволяют центральным таксонам оказывать косвенное влияние на микробные сообщества, воздействуя на хозяина и вызывая предпочтения сортировки видов растений. Кроме того, узловые таксоны также непосредственно ингибируют или способствуют росту других микробов, влияющих на общие взаимосвязанные сообщества (Agler et al., 2016).
al., 2016; Lareen et al., 2016; van Overbeek and Saikkonen, 2016; Busby et al., 2017; Yang et al., 2017; Zhang et al., 2017). Недавно была предложена и подтверждена роль некоторых микробных таксонов («хабовых» таксонов) в формировании микробиомов растений в ответ на абиотические факторы и факторы хозяина (Agler et al., 2016). Центральные таксоны были определены как микробные группы, которые значительно более связаны внутри сети, чем другие группы, на основе измерений центральности, таких как степень, центральность промежуточности и центральность близости. Сильные взаимодействия растений и микробов позволяют центральным таксонам оказывать косвенное влияние на микробные сообщества, воздействуя на хозяина и вызывая предпочтения сортировки видов растений. Кроме того, узловые таксоны также непосредственно ингибируют или способствуют росту других микробов, влияющих на общие взаимосвязанные сообщества (Agler et al., 2016).
Бактериальные и грибковые сообщества играют важную роль в микробиомах почвы и растений (van Overbeek and Saikkonen, 2016), а также в усвоении растениями питательных веществ и адаптации к стрессу (Vandenkoornhuyse et al. , 2015). Наряду с археями, бактериями и грибами протисты широко распространены в почвах и представлены филогенетически разнообразной группой. Почвенные протисты выполняют широкий спектр функций, влияющих на плодородие почвы и здоровье растений. Эти функции включают модуляцию популяций бактерий, грибков, водорослей и нематод (Geisen, 2016; Geisen et al., 2015a), влияя на круговорот питательных веществ в почве (Seppey et al., 2017) и оказывая патогенное воздействие на животных и растения (Geisen et al., 2015b). Протисты играют центральную роль в объединении бактериальных и грибковых популяций почвы в единую и сложную экологическую сеть (Xiong et al., 2017) с преобладанием антагонистических взаимодействий, обнаруженных между царствами, и мутуалистических взаимодействий, обнаруженных внутри царств (Agler et al., 2016). ). Структуры сообществ протистов согласуются в пределах типов местообитаний и географических регионов (Grossmann et al., 2016) и под влиянием биотических и абиотических факторов (Xiong et al.
, 2015). Наряду с археями, бактериями и грибами протисты широко распространены в почвах и представлены филогенетически разнообразной группой. Почвенные протисты выполняют широкий спектр функций, влияющих на плодородие почвы и здоровье растений. Эти функции включают модуляцию популяций бактерий, грибков, водорослей и нематод (Geisen, 2016; Geisen et al., 2015a), влияя на круговорот питательных веществ в почве (Seppey et al., 2017) и оказывая патогенное воздействие на животных и растения (Geisen et al., 2015b). Протисты играют центральную роль в объединении бактериальных и грибковых популяций почвы в единую и сложную экологическую сеть (Xiong et al., 2017) с преобладанием антагонистических взаимодействий, обнаруженных между царствами, и мутуалистических взаимодействий, обнаруженных внутри царств (Agler et al., 2016). ). Структуры сообществ протистов согласуются в пределах типов местообитаний и географических регионов (Grossmann et al., 2016) и под влиянием биотических и абиотических факторов (Xiong et al. , 2017; Yurgel et al., 2017). Несмотря на свою важность в почвенных экосистемах, протисты остаются наименее изученными микроорганизмами в почве. В частности, связанные с растениями сообщества протистанов и их роль во взаимодействии растений и микробиомов изучены недостаточно.
, 2017; Yurgel et al., 2017). Несмотря на свою важность в почвенных экосистемах, протисты остаются наименее изученными микроорганизмами в почве. В частности, связанные с растениями сообщества протистанов и их роль во взаимодействии растений и микробиомов изучены недостаточно.
Vaccinium angustifolium (дикая голубика) Управление разработано для приведения сельскохозяйственных полевых стандартов к естественным местам обитания дикой голубики, но с сохранением этих условий, близких к естественным (Hall et al., 1979; Итон, 1988 год; Белл и др., 2009 г.; Драммонд и др., 2009). Недавно мы использовали эту систему для изучения бактериальных, грибковых и негрибковых эукариотических сообществ и их реакции на биотические и абиотические факторы в отдельной статье. Мы обнаружили, что почвенные бактерии и эукариоты по-разному реагировали на биотические и абиотические факторы: на почвенные эукариоты больше влияли химические характеристики почвы, а бактерии сильнее реагировали на присутствие растения (Юргель и др. , 2017). В этом исследовании мы использовали управляемые и естественные экосистемы дикой голубики для изучения взаимодействия между растением и его микробиомом, уделяя особое внимание корневым бактериальным и эукариотическим сообществам, которые в основном состоят из эндофитных микроорганизмов.Мы оценили, как совокупные различия между лесными и управляемыми системами влияют на микробиом корней, и определили несколько эукариотических таксонов, связанных с урожайностью полевых фруктов. Мы также проанализировали корреляции между царствами в почвенной и связанной с корнями микробиоте, чтобы определить наиболее связанные (концентрационные) микробные таксоны в почве и связанных с корнями сообществах. В результате это исследование дает комплексный взгляд на сообщества, связанные с почвой и растениями, и определяет микробные таксоны, имеющие потенциальное значение для здоровья и производства растений.
, 2017). В этом исследовании мы использовали управляемые и естественные экосистемы дикой голубики для изучения взаимодействия между растением и его микробиомом, уделяя особое внимание корневым бактериальным и эукариотическим сообществам, которые в основном состоят из эндофитных микроорганизмов.Мы оценили, как совокупные различия между лесными и управляемыми системами влияют на микробиом корней, и определили несколько эукариотических таксонов, связанных с урожайностью полевых фруктов. Мы также проанализировали корреляции между царствами в почвенной и связанной с корнями микробиоте, чтобы определить наиболее связанные (концентрационные) микробные таксоны в почве и связанных с корнями сообществах. В результате это исследование дает комплексный взгляд на сообщества, связанные с почвой и растениями, и определяет микробные таксоны, имеющие потенциальное значение для здоровья и производства растений.
Материалы и методы
Коллекция образцов
Образцы корней, ризосферы и насыпной почвы дикой голубики, использованные в этом исследовании, были собраны в августе 2015 г. (Юргель и др., 2017). Сбор проб, подготовка, секвенирование и первичный биоинформатический анализ микробных сообществ из ризосферы и насыпи были опубликованы ранее (Юргель и др., 2017). Мы включили эти данные секвенирования, полученные из образцов ризосферы и объемной почвы, в это исследование, а также для дальнейшего анализа и сравнения с данными секвенирования, полученными из образцов корней.Образцы, использованные в этом исследовании, были собраны на шести управляемых полях голубики и на двух лесных участках, прилегающих к полям Института голубики Новой Шотландии (NSBI) в Деберте, и на коммерческом поле, расположенном недалеко от Коллингвуд-Корнер, Канада (Yurgel et al., 2017) (дополнительная таблица S1). ). Три управляемых поля имели историю производства низкоурожайных фруктов, а три других имели историю производства высоких урожаев фруктов. После сбора ризосферных почв с корней дикой голубики образцы MngRhizo и FrstRhizo (Юргель и др., 2017), образцы MngRoot и FrstRoot хранили в стерильных пробирках Falcon объемом 50 мл при температуре -86°C.
 В общей сложности было собрано 15 корней натуральных (FrstRoot) и 34 корня искусственных (MngRoot) растений (дополнительная таблица S1).
В общей сложности было собрано 15 корней натуральных (FrstRoot) и 34 корня искусственных (MngRoot) растений (дополнительная таблица S1).
Подготовка образцов корневой ткани
Для выделения ДНК около 1 г каждого корня помещали в пробирку объемом 15 мл с 10 мл стерильной воды и обрабатывали ультразвуком в течение 60 с при 20°С в ультразвуковой водяной бане с частотой 35 кГц. Затем каждый образец корня удаляли из пробирки и помещали в новую пробирку с 10 мл стерильной воды и снова обрабатывали ультразвуком в течение 60 с.Этот шаг был повторен дважды. Очищенные корни разрезали на кусочки размером 5 мм с помощью стерильных ножниц и затем помещали в стерилизованные смертные. Образцы замораживали в жидком азоте и измельчали стерильным пестиком в мелкий порошок. Всего для выделения ДНК использовали 0,250 г измельченной корневой ткани.
Экстракция ДНК и секвенирование
Экстракцию ДНК проводили с использованием набора для выделения ДНК PowerSoil (MO BIO Laboratories, Карлсбад, Калифорния, США) в соответствии с протоколом производителя. Этот же набор для выделения ДНК ранее использовался для выделения ДНК из ризосферы и насыпной почвы (Юргель и др., 2017). Качество и концентрацию ДНК измеряли с помощью спектрофотометра NanoDrop 1000 (Thermo Scientific, Уолтем, Массачусетс, США). Не менее 50 нг (10 мкл) образца ДНК было отправлено в CGEB-IMR Университета Далхаузи для гена 16S рРНК V6–V8 (16S; вперед: ACGCGHNRAACCTTACC; наоборот: ACGGGCRGTGWGTRCAA) и гена 18S рРНК V4 (18S; вперед: CYGCGGTAATTCCAGCTC; реверс: AYGGTATCTRATCRTCTTYG) подготовка библиотеки и секвенирование.Образцы мультиплексировали с использованием подхода с двойной индексацией и секвенировали с использованием Illumina MiSeq с считыванием парных концов 300 + 300 п.н. Все процедуры ПЦР и детали секвенирования Illumina были такими же, как описано ранее (Comeau et al., 2016; Yurgel et al., 2017). Все последовательности, созданные в этом исследовании, доступны в архиве чтения последовательностей NCBI под номерами доступа PRJNA434066 (16S) и PRJNA434067 (18S).
Этот же набор для выделения ДНК ранее использовался для выделения ДНК из ризосферы и насыпной почвы (Юргель и др., 2017). Качество и концентрацию ДНК измеряли с помощью спектрофотометра NanoDrop 1000 (Thermo Scientific, Уолтем, Массачусетс, США). Не менее 50 нг (10 мкл) образца ДНК было отправлено в CGEB-IMR Университета Далхаузи для гена 16S рРНК V6–V8 (16S; вперед: ACGCGHNRAACCTTACC; наоборот: ACGGGCRGTGWGTRCAA) и гена 18S рРНК V4 (18S; вперед: CYGCGGTAATTCCAGCTC; реверс: AYGGTATCTRATCRTCTTYG) подготовка библиотеки и секвенирование.Образцы мультиплексировали с использованием подхода с двойной индексацией и секвенировали с использованием Illumina MiSeq с считыванием парных концов 300 + 300 п.н. Все процедуры ПЦР и детали секвенирования Illumina были такими же, как описано ранее (Comeau et al., 2016; Yurgel et al., 2017). Все последовательности, созданные в этом исследовании, доступны в архиве чтения последовательностей NCBI под номерами доступа PRJNA434066 (16S) и PRJNA434067 (18S).
Обработка данных секвенирования
Обработка данных последовательности и выбор OTU были описаны в нашей предыдущей работе (Yurgel et al. , 2017). Короче говоря, для обработки и анализа данных секвенирования использовалась стандартная операционная процедура Microbiome Helper (Comeau et al., 2017). Перекрывающиеся чтения с парными концами были сшиты вместе с использованием PEAR (v0.9.6) (Zhang et al., 2014). FASTX-Toolkit (v0.0.14) (Gordon and Hannon, 2010) должен был отфильтровывать чтения с показателем качества менее 30 на >10% позиций. Кроме того, с помощью BBMap (v35.85) (Бушнелл, 2014). Химерные прочтения нужно было отсеять, запустив USEARCH (v6.1) (Edgar et al., 2011; Bushnell, 2014) с параметрами mindiv = 1,5 и minh = 0,2.
, 2017). Короче говоря, для обработки и анализа данных секвенирования использовалась стандартная операционная процедура Microbiome Helper (Comeau et al., 2017). Перекрывающиеся чтения с парными концами были сшиты вместе с использованием PEAR (v0.9.6) (Zhang et al., 2014). FASTX-Toolkit (v0.0.14) (Gordon and Hannon, 2010) должен был отфильтровывать чтения с показателем качества менее 30 на >10% позиций. Кроме того, с помощью BBMap (v35.85) (Бушнелл, 2014). Химерные прочтения нужно было отсеять, запустив USEARCH (v6.1) (Edgar et al., 2011; Bushnell, 2014) с параметрами mindiv = 1,5 и minh = 0,2.
OTU (Операционная таксономическая единица) Сбор и статистический анализ
Следуя этим шагам фильтрации, мы запустили сбор OTU с открытым эталоном, используя сценарии-оболочки QIIME (Caporaso et al., 2010). В частности, SortMeRNA [v2.0-dev; (Копылова и др., 2012)] использовалась для эталонных шагов пикинга OTU (с sortmerna_coverage = 0.8) и sumaclust (v1.0.00) (Mercier et al., 2013) для шагов выбора OTU de novo (с 10% сбоев в подвыборке). Мы отфильтровали OTU, которые содержали менее 0,1% от общего числа последовательностей, чтобы компенсировать просачивание MiSeq от запуска к запуску (см. Comeau et al., 2016). Метрики альфа-разнообразия (богатство и Chao1) и бета-разнообразия (взвешенное расстояние UniFrac) (Lozupone et al., 2011) были созданы с использованием QIIME. Вариации в группах образцов, объясняемые взвешенными расстояниями бета-разнообразия UniFrac (тесты Адониса, 999 перестановок), были запущены в QIIME для расчета того, как группировки образцов связаны со структурой микробного сообщества.Анализ таксономических профилей и анализ основных координат (PCoA) выполняли с использованием программного пакета STAMP (Parks et al., 2014). Скорректированные значения P ( q -значения) были рассчитаны на основе коррекции множественного теста FDR Бенджамини-Хохберга.
Мы отфильтровали OTU, которые содержали менее 0,1% от общего числа последовательностей, чтобы компенсировать просачивание MiSeq от запуска к запуску (см. Comeau et al., 2016). Метрики альфа-разнообразия (богатство и Chao1) и бета-разнообразия (взвешенное расстояние UniFrac) (Lozupone et al., 2011) были созданы с использованием QIIME. Вариации в группах образцов, объясняемые взвешенными расстояниями бета-разнообразия UniFrac (тесты Адониса, 999 перестановок), были запущены в QIIME для расчета того, как группировки образцов связаны со структурой микробного сообщества.Анализ таксономических профилей и анализ основных координат (PCoA) выполняли с использованием программного пакета STAMP (Parks et al., 2014). Скорректированные значения P ( q -значения) были рассчитаны на основе коррекции множественного теста FDR Бенджамини-Хохберга.
Построение и анализ сети совпадений
Анализ совместной встречаемости был выполнен с использованием R-пакета CCREPE (Compositionality Corrected by REnormalization and PErmutation) (Schwager, в печати), который ранее использовался для построения сетей совместной встречаемости на основе данных микробного секвенирования (Gevers et al. , 2014; Васкес-Баеза и др., 2016). В этой сети используется новая мера подобия, N-мерная оценка шахматной доски (NC-оценка) (Stone and Roberts, 1990), которая особенно подходит для композиций, полученных на основе данных секвенирования микробного сообщества. Микробы, обнаруженные менее чем в 5% образцов, были исключены из анализа. Также были удалены таксоны, представленные менее чем 1% прочтений во всех выборках. Во-первых, были оценены модели совместного появления и совместного исключения в выборках. Полученные результаты были отфильтрованы для удаления статистически значимых связей.Мы создали 12 сетей на основе сильных корреляций с p -значениями <0,01, 0,001, 0,0001 и пороговыми значениями Бонферрони на уровне рода, семейства и отряда. Данные были загружены в Cytoscape 3.4.0 (Shannon et al., 2003) и использованы для расчета статистики узла, такой как степень, центральность по промежуточности и центральность по близости. Мы использовали функции Excel НОРМ.РАСП, чтобы подогнать нормальное распределение к параметрам степени, центральности промежуточности или центральности близости, чтобы определить значения, выше которых узлы можно считать выбросами, соответствующие p < 0.
, 2014; Васкес-Баеза и др., 2016). В этой сети используется новая мера подобия, N-мерная оценка шахматной доски (NC-оценка) (Stone and Roberts, 1990), которая особенно подходит для композиций, полученных на основе данных секвенирования микробного сообщества. Микробы, обнаруженные менее чем в 5% образцов, были исключены из анализа. Также были удалены таксоны, представленные менее чем 1% прочтений во всех выборках. Во-первых, были оценены модели совместного появления и совместного исключения в выборках. Полученные результаты были отфильтрованы для удаления статистически значимых связей.Мы создали 12 сетей на основе сильных корреляций с p -значениями <0,01, 0,001, 0,0001 и пороговыми значениями Бонферрони на уровне рода, семейства и отряда. Данные были загружены в Cytoscape 3.4.0 (Shannon et al., 2003) и использованы для расчета статистики узла, такой как степень, центральность по промежуточности и центральность по близости. Мы использовали функции Excel НОРМ.РАСП, чтобы подогнать нормальное распределение к параметрам степени, центральности промежуточности или центральности близости, чтобы определить значения, выше которых узлы можно считать выбросами, соответствующие p < 0. 1. Узлы со степенью, центральностью между и центральностью близости выше p -значение = 0,1 для всех трех параметров по крайней мере в двух из четырех корреляционных сетей на основе p -значения <0,01, 0,001, 0,0001 и пороги Бонферрони считались узловыми таксонами. Сети визуализировались с помощью Cytoscape и представлялись в виде графов с микробными группами в качестве вершин/узлов и ребрами в качестве типов взаимодействия.
1. Узлы со степенью, центральностью между и центральностью близости выше p -значение = 0,1 для всех трех параметров по крайней мере в двух из четырех корреляционных сетей на основе p -значения <0,01, 0,001, 0,0001 и пороги Бонферрони считались узловыми таксонами. Сети визуализировались с помощью Cytoscape и представлялись в виде графов с микробными группами в качестве вершин/узлов и ребрами в качестве типов взаимодействия.
Результаты
Состав микробных сообществ корня дикой черники
Всего было получено 5 569 830 высококачественных последовательностей 18S и 595 992 высококачественных последовательностей 16S из 49 образцов корней растений из управляемых (MngRoot) и естественных местообитаний (FrstRoot).OTU растительного происхождения Archaeplastida и Chloroplast были представлены 5 332 133 считываниями 18S и 29 411 считываниями 16S соответственно. Для прямого сравнения разнообразия и структуры микробных сообществ в экологических нишах необработанные данные секвенирования образцов корней из планов из управляемых (MngRoot) и естественных местообитаний (FrstRoot) были объединены с необработанными данными секвенирования, полученными из соответствующих образцов ризосферы из планов из управляемых растений. (MngRhizo) и естественных местообитаний (FrstRhizo), а также объемные образцы почвы из управляемых (MngBulk) и естественных местообитаний (FrstBulk) (Yurgel et al., 2017) для обработки, отбора ОТЕ и статистического анализа.
(MngRhizo) и естественных местообитаний (FrstRhizo), а также объемные образцы почвы из управляемых (MngBulk) и естественных местообитаний (FrstBulk) (Yurgel et al., 2017) для обработки, отбора ОТЕ и статистического анализа.
Эукариотические сообщества
Всего было получено 7 036 418 высококачественных последовательностей 18S из корневых, ризосферных (MngRhizo, FrstRhizo) и массовых (MngBulk, FrstBulk) образцов. Чтобы удалить OTU растительного происхождения, последовательности 18S, аннотированные как Archaeplastida/Plantae , и неназначенные OTU были отфильтрованы. Всего в наборе данных осталась 1 328 201 высококачественная последовательность 18S. После нормализации до глубины 1922 прочтений (глубина наименьшего набора данных после удаления 8 самых низких выборок) было сохранено 253704 прочтений, включая 80724 высококачественных последовательности 18S, представляющих корневое сообщество из 42 образцов.Эти чтения были распределены среди 1731 OTU во всех экологических нишах и среди 996 OTU в образцах корней с идентичностью 97% (рис. 1A). Около 52% (896) OTU были общими для основной почвы, ризосферы и корневых местообитаний, в то время как только 1% OTU были специфичны для основной почвы, ризосферы или корневых ниш. Значительная доля OTU (688 OTU, ~40%) была разделена только между балком и ризосферой.
1A). Около 52% (896) OTU были общими для основной почвы, ризосферы и корневых местообитаний, в то время как только 1% OTU были специфичны для основной почвы, ризосферы или корневых ниш. Значительная доля OTU (688 OTU, ~40%) была разделена только между балком и ризосферой.
РИСУНОК 1. Диаграмма Венна , показывающая специфические и общие OTU в основной, ризосферной и корневой нишах. (А) 18S рРНК; (B) Bacteria16S рРНК.
Во всех экологических нишах 1201 негрибковая OTU, включая Alveolata (343 OTU), Metazoa (286 OTU), Cercozoa (283 OTU), Hacrobia (120 OTU77), 80077 Hacrobia (9077 OTU) и Nematoda (64 OTU). Первые 15 наиболее относительно распространенных классов эукариот, связанных с корнями (рис. 2А), представляли примерно 93% всех прочтений, идентифицированных в образцах корней, и только 67 и 57% всех прочтений 18S, идентифицированных в образцах основной массы и ризосферы, соответственно. Около 92% общего числа прочтений, идентифицированных в образцах корней, были классифицированы как деление Opisthokonts . Из них грибы были представлены 76% прочтений, в том числе 72% Ascomycota и 2% Basidiomycota и Mucoromycota каждый (рис. 2А). Другие таксоны грибов, выявленные в ходе исследования, включали Glomeromycota , Mucoromycotina и Chytridiomycota . Наиболее относительно многочисленными негрибными корневыми эукариотами были Metazoa , кольчатые черви Annelida (4%, 7 OTU), Nematoda (2%, 12 OTU), Arthropoda (1.4%, 6 OTU) и Cercozoa (4%, 30 OTU).
РИСУНОК 2. Таксоны микроорганизмов, выявленные в ходе исследования. (A) Bacteria16S рРНК; (Б) 18S рРНК.
Бактериальные сообщества
Всего было получено 3 232 834 высококачественных последовательности 16S из корней, ризосферы и массовых образцов. Чтения, аннотированные как Chloroplast , были отфильтрованы, в результате чего осталось 3 186 706 высококачественных последовательностей 16S. Наборы данных были нормализованы к глубине наименьшего набора данных, 7 136 прочтений, а в ризосфере и объемных образцах было сохранено 349 664 и 335 392 прочтений соответственно. Корневое сообщество было представлено 349 664 высококачественными последовательностями 16S в 49 образцах. Эти чтения были распределены среди 8058 OTU во всех экологических нишах, из которых 6802 OTU также были обнаружены в образцах корней с идентичностью 99% (рис. 1B). Более 80% (6 466 OTU) были разделены между тремя средами обитания. Объемные, ризосферные и специфичные для корней OTU составили 1.5, 0,2 и 0,1% от общего числа OTU, соответственно, и 14% OTU (1120) были разделены между основной массой и ризосферой. Первые 15 наиболее относительно распространенных классов бактерий, ассоциированных с корнями, представляли примерно 94% всех прочтений 16S рРНК, идентифицированных в образцах корней, и примерно 83 и 89% всех прочтений, идентифицированных в образцах основной массы и ризосферы, соответственно. Наиболее многочисленными классами бактерий, обнаруженными в образцах корней, были Proteobacteria (37%), в том числе Alphaproteobacteria (23%) и Gammaproteobacteria (8%), Acidobacteria (26%), Actinobacteria (16%), .
Наборы данных были нормализованы к глубине наименьшего набора данных, 7 136 прочтений, а в ризосфере и объемных образцах было сохранено 349 664 и 335 392 прочтений соответственно. Корневое сообщество было представлено 349 664 высококачественными последовательностями 16S в 49 образцах. Эти чтения были распределены среди 8058 OTU во всех экологических нишах, из которых 6802 OTU также были обнаружены в образцах корней с идентичностью 99% (рис. 1B). Более 80% (6 466 OTU) были разделены между тремя средами обитания. Объемные, ризосферные и специфичные для корней OTU составили 1.5, 0,2 и 0,1% от общего числа OTU, соответственно, и 14% OTU (1120) были разделены между основной массой и ризосферой. Первые 15 наиболее относительно распространенных классов бактерий, ассоциированных с корнями, представляли примерно 94% всех прочтений 16S рРНК, идентифицированных в образцах корней, и примерно 83 и 89% всех прочтений, идентифицированных в образцах основной массы и ризосферы, соответственно. Наиболее многочисленными классами бактерий, обнаруженными в образцах корней, были Proteobacteria (37%), в том числе Alphaproteobacteria (23%) и Gammaproteobacteria (8%), Acidobacteria (26%), Actinobacteria (16%), . Bacteroidetes Saprospirae (5%), Chloroflexi Ktedonobacteria (4%) и Verrucomicrobia Spartobacteria (2%) (рис. 2B).
Bacteroidetes Saprospirae (5%), Chloroflexi Ktedonobacteria (4%) и Verrucomicrobia Spartobacteria (2%) (рис. 2B).
Переход микробных сообществ из ризосферы в корень
Визуализация различий между эукариотическими сообществами во всех экологических нишах с использованием анализа основных координат (PCA) показала четкое разделение между почвенной массой / ризосферой (MngBulk, FrstBulk, MngRhizo и FrstRhizo) и корневыми (MngRoot и FrstRoot) сообществами (дополнительный рисунок S1A). Анализ силы и статистической значимости группировок выборки (критерий Адониса) показал, что ниша (объемная, ризосферная и корневая) связана со структурой эукариотического сообщества ( R 2 = 0.18, p < 0,001). Еще большая сила группировок образцов была обнаружена при рассмотрении только ризосферы и корневых ниш ( R 2 = 0,23, p < 0,001). Попарные сравнения богатства Chao1, равномерности Симпсона и разнообразия Шеннона выявили значительное снижение альфа-разнообразия корневых эукариотических сообществ по сравнению с ризосферными и массовыми сообществами (дополнительный рисунок S2A). Учитывая таксономические группы, относительная численность ряда других эукариотических таксонов, таких как Arthropoda , Dinophyceae , Prymnesiophyceae , Spirotrichea и Urochordata , была значительно ниже на дополнительном рисунке 3A и дополнительном рисунке 3A. корня по сравнению с ризосферой.Были рассмотрены только таксоны, представленные >50 и >250 прочтений 18S и 16S соответственно. Относительная численность грибов была снижена в ризосфере по сравнению с насыпной почвой, но увеличена в корнях. В частности, относительное обилие Pezizomycotina , к которому относится большинство аскомицетообразных патогенов и мутуалистов, было значительно выше в корне по сравнению с ризосферой. Сюда входят классы Sordariomycetes , Leotiomycetes , содержащие множество фитопатогенов и микоризных грибов, предполагаемые эрикоидные микоризные грибы Lachnum (Glawe, 2008; Walker et al., 2011; Bizabani and Dames, 2015), а также потенциальный рост растений, способствующий темному септированному эндофиту Phialocephala (Rodriguez et al.
Учитывая таксономические группы, относительная численность ряда других эукариотических таксонов, таких как Arthropoda , Dinophyceae , Prymnesiophyceae , Spirotrichea и Urochordata , была значительно ниже на дополнительном рисунке 3A и дополнительном рисунке 3A. корня по сравнению с ризосферой.Были рассмотрены только таксоны, представленные >50 и >250 прочтений 18S и 16S соответственно. Относительная численность грибов была снижена в ризосфере по сравнению с насыпной почвой, но увеличена в корнях. В частности, относительное обилие Pezizomycotina , к которому относится большинство аскомицетообразных патогенов и мутуалистов, было значительно выше в корне по сравнению с ризосферой. Сюда входят классы Sordariomycetes , Leotiomycetes , содержащие множество фитопатогенов и микоризных грибов, предполагаемые эрикоидные микоризные грибы Lachnum (Glawe, 2008; Walker et al., 2011; Bizabani and Dames, 2015), а также потенциальный рост растений, способствующий темному септированному эндофиту Phialocephala (Rodriguez et al. , 2009; Lukesova et al., 2015; Schlegel et al., 2016).
, 2009; Lukesova et al., 2015; Schlegel et al., 2016).
Аналогично анализу эукариотических измельченных частиц, PCoA показал четкое разделение между массовыми, ризосферными и корневыми бактериальными сообществами (дополнительный рисунок S1B). Анализ прочности и статистической значимости группировок образцов показал, что ниша (объемная, ризосферная и корневая) влияла на структуру бактериального сообщества ( R 2 = 0.26, p < 0,001). Однако при учете только ризосферы и корневых ниш выявлена меньшая прочность группировок образцов ( R 2 = 0,17, p < 0,001). Точно так же, как и в случае с эукариотами, богатство Chao1, равномерность Симпсона и разнообразие Шеннона значительно уменьшились в связанных с корнями бактериальных сообществах по сравнению с ризосферными и объемными сообществами (дополнительная фигура S2B). Учитывая таксономические группы, относительная численность нескольких таксонов бактерий, в том числе Chthoniobacteriales , Acidobacteriales , Ellin6513 , Solibacterales и Syntrophobacteriales , была значительно снижена в корне по сравнению с ризо. Относительная численность Ellin6513 также была снижена в ризосфере по сравнению с основной почвой. И наоборот, относительная численность Saprospirales , Actinomycetales , Rhizobiales и Xanthomonadales увеличилась относительной численности по мере приближения к растению, с меньшей относительной численностью в основной массе почвы и максимальной в корнях (дополнительная фигура S3B).
Относительная численность Ellin6513 также была снижена в ризосфере по сравнению с основной почвой. И наоборот, относительная численность Saprospirales , Actinomycetales , Rhizobiales и Xanthomonadales увеличилась относительной численности по мере приближения к растению, с меньшей относительной численностью в основной массе почвы и максимальной в корнях (дополнительная фигура S3B).
Влияние управления и полевого производства
Менеджмент оказал незначительное влияние на корневые эукариоты (тест Адониса, R 2 = 0.10, p < 0,05), и не было обнаружено различий в относительной численности эукариот между образцами MngRoot и FrstRoot. Однако, когда образцы ризосферы и корней были проанализированы вместе, арбускулярные микоризные грибы Glomeromycota (Davison et al., 2015) и травоядные Nematoda были относительно более многочисленными, а животные и грибковые патогены Kickxellomycota (Spatafora et al. , 2016), в лесу было относительно меньше, чем на полях (дополнительный рисунок S4A).Были рассмотрены только таксоны, представленные >50 и >250 прочтений 18S и 16S соответственно. По сравнению с эукариотами управление оказывает более сильное влияние на корневые бактериальные сообщества (тест Адониса, R 2 = 0,14, p < 0,01). Бактериальные порядки Chthoniobacteralales , ELLIN6513 , Солирубробактериалы и были более низкие относительные изобилия, в то время как порядки Rhodospirillalales и солибактериалов имели более высокие относительные изобилия в Frstroot по сравнению с образцами Mngroot (дополнительная фигура S4B).Кроме того, различия в относительной численности Chthoniobacterales , Ellin6513 , Thermogemmatisporales и Rhodospirillales также были обнаружены между образцами MngRhizo и FrstRhizo (дополнительная фигура S4B). Когда все ниши из управляемых местообитаний были проанализированы вместе, незначительная, но статистически значимая корреляция между продуктивностью полевых фруктов и структурой эукариот (критерий Адониса, R 2 = 0,04, p < 0.
, 2016), в лесу было относительно меньше, чем на полях (дополнительный рисунок S4A).Были рассмотрены только таксоны, представленные >50 и >250 прочтений 18S и 16S соответственно. По сравнению с эукариотами управление оказывает более сильное влияние на корневые бактериальные сообщества (тест Адониса, R 2 = 0,14, p < 0,01). Бактериальные порядки Chthoniobacteralales , ELLIN6513 , Солирубробактериалы и были более низкие относительные изобилия, в то время как порядки Rhodospirillalales и солибактериалов имели более высокие относительные изобилия в Frstroot по сравнению с образцами Mngroot (дополнительная фигура S4B).Кроме того, различия в относительной численности Chthoniobacterales , Ellin6513 , Thermogemmatisporales и Rhodospirillales также были обнаружены между образцами MngRhizo и FrstRhizo (дополнительная фигура S4B). Когда все ниши из управляемых местообитаний были проанализированы вместе, незначительная, но статистически значимая корреляция между продуктивностью полевых фруктов и структурой эукариот (критерий Адониса, R 2 = 0,04, p < 0. 05), но не бактериальные сообщества (тест Адониса, R 2 = 0,02, p > 0,05). Поля с более низкой урожайностью плодов имели более высокую относительную численность паразитических грибов Cryptomycotina (Letcher et al., 2017), планирующих бактериофагов/водорослей Glissomonadida ( Cercozoa ) (Howe et al., 2009) и Vampyrellida ( 9 Rhizaria ) (Hess, 2017) (дополнительный рисунок S5). Были рассмотрены только таксоны, представленные >50 18S.
05), но не бактериальные сообщества (тест Адониса, R 2 = 0,02, p > 0,05). Поля с более низкой урожайностью плодов имели более высокую относительную численность паразитических грибов Cryptomycotina (Letcher et al., 2017), планирующих бактериофагов/водорослей Glissomonadida ( Cercozoa ) (Howe et al., 2009) и Vampyrellida ( 9 Rhizaria ) (Hess, 2017) (дополнительный рисунок S5). Были рассмотрены только таксоны, представленные >50 18S.
Межкоролевская корреляция в микробиомах дикой черники
Мы создали сеть совместной встречаемости, сопоставив относительную численность микробных таксонов, обнаруженных в ≥5% образцов из корней, ризосферы и сыпучих почв, с таксонами, сгруппированными по роду (рис. 3), семейству (дополнительный рисунок S6A) и уровням порядка. (Дополнительный рисунок S6B). Мы использовали отсечку Бонферрони для удаления корреляций с низкими значениями p . Эти оставшиеся корреляции были использованы для построения комбинированных представлений сети совместного появления с «пружиной, взвешенной по краям», в которой положительные корреляции (синие) стягивают выборки вместе, образуя кластеры, а отрицательные корреляции (красные) раздвигают выборки.
РИСУНОК 3. Сеть совместной встречаемости, созданная путем измерения совместной корреляции численности микробных таксонов из корней и ризосферы и насыпи почвы. Анализ корреляционной базы, показывающий потенциальное взаимодействие между родами бактерий, грибков и простейших. Размер узла пропорционален средней относительной численности таксона во всех выборках. Линии, соединяющие узлы (ребра), представляют положительное (синее) или отрицательное (красное) отношение совпадения.Интенсивность цвета и длина краев представляют силу корреляции. Таксоны, показанные на рисунке, являются центральными таксонами, которые были идентифицированы как те, которые были значительно более центральными на основе измерений степени, центральности по промежуточности и центральности по близости ( p > 0,1 на основе подгонки нормального распределения). Таксоны, выделенные жирным шрифтом, были обнаружены как центральные таксоны, по крайней мере, в двух сетях совместной встречаемости на основе обилия микроорганизмов, сгруппированных на уровне рода, семейства или отряда.
Для всех трех сетей визуально выявлено три основных микробных скопления. Кластер A1 был в основном занят эукариотами Metazoa , Hacrobia , Alveolata и Radiolaria (рис. 3 и дополнительные рисунки S6A, B), многие из которых ранее были связаны с водной средой. Эти эукариоты отрицательно коррелировали с таксоном в Glissomonadida из кластеров A3 и Pezizomycotina , которые были разбросаны по сети на основе группировки на уровне рода (рис. 3) или стояли отдельно в сетях на основе группировки на уровне семейства и отряда. (Дополнительные рисунки S6B).Бактериальные таксоны, обнаруженные в этом кластере, включают Verrucomicrobia , Planctomycetes и Candidatus Solibacter . Эукариоты имели более высокую комбинированную относительную численность в ризосфере по сравнению с основной массой почвы и корнями (дополнительная фигура S7A).
Кластеры A2 были в основном представлены бактериальными таксонами из Alpha-, Beta- и Gammaproteobacteria, Bacteroidetes и Actinobacteria . Этот кластер имел сильную отрицательную корреляцию с Ascomycota и бактериальными таксонами из кластеров 3 (рис. 3 и дополнительные рисунки S6A, B).Кластеры A2 продемонстрировали увеличение комбинированной относительной численности при переходе от основной части к ризосфере и от ризосферы к корню (дополнительная фигура S7A). Грибки, в том числе потенциальные патогены, хищники Cercozoa , arthropoda , Nematoda и ROOTIFERS и BACTERIAL, acidobacteria, Chloroflexi и Verrucomicrobia были наиболее обильными таксонами, принадлежащими к кластерам 3 (рисунок 3 и дополнительные Фигуры S6A,B). На совокупную относительную численность обоих царств в этом кластере отрицательно повлияла близость растения (дополнительная фигура S7A).
Этот кластер имел сильную отрицательную корреляцию с Ascomycota и бактериальными таксонами из кластеров 3 (рис. 3 и дополнительные рисунки S6A, B).Кластеры A2 продемонстрировали увеличение комбинированной относительной численности при переходе от основной части к ризосфере и от ризосферы к корню (дополнительная фигура S7A). Грибки, в том числе потенциальные патогены, хищники Cercozoa , arthropoda , Nematoda и ROOTIFERS и BACTERIAL, acidobacteria, Chloroflexi и Verrucomicrobia были наиболее обильными таксонами, принадлежащими к кластерам 3 (рисунок 3 и дополнительные Фигуры S6A,B). На совокупную относительную численность обоих царств в этом кластере отрицательно повлияла близость растения (дополнительная фигура S7A).
Когда пороговые значения Bonferroni p использовались для выбора сильных корреляций, корреляции между царствами были представлены примерно 21% всех корреляций с более высокой долей положительных корреляций (~68%) по сравнению с отрицательными (32%). %) (рис. 4А). Внутри каждого царства корреляции эукариот и бактерий были представлены 42 и 37% соответственно. Внутри царств положительные и отрицательные корреляции были относительно равномерно распределены (рис. 4B, C), при этом 48 и 43% отрицательных корреляций находились внутри эукариот и внутри бактерий соответственно.Положительные корреляции между эукариотическими организмами показали четкое разделение на две группы с низкой силой корреляции (оценка NC <0,58) и высокой оценкой силы корреляции (оценка NC <0,65). Все корреляции с грибами были расположены в группе с низкой силой корреляции (красные столбцы на рисунке 4B) со средней оценкой NC, значительно более низкой, чем у корреляций, не связанных с грибами ( p < 10 -28 ).
%) (рис. 4А). Внутри каждого царства корреляции эукариот и бактерий были представлены 42 и 37% соответственно. Внутри царств положительные и отрицательные корреляции были относительно равномерно распределены (рис. 4B, C), при этом 48 и 43% отрицательных корреляций находились внутри эукариот и внутри бактерий соответственно.Положительные корреляции между эукариотическими организмами показали четкое разделение на две группы с низкой силой корреляции (оценка NC <0,58) и высокой оценкой силы корреляции (оценка NC <0,65). Все корреляции с грибами были расположены в группе с низкой силой корреляции (красные столбцы на рисунке 4B) со средней оценкой NC, значительно более низкой, чем у корреляций, не связанных с грибами ( p < 10 -28 ).
РИСУНОК 4. Сила корреляции (оценка NS), полученная путем анализа корреляций между микробными родами с использованием пакета R CCREPE (Compositionality Corrected by REnormalization and PERmutation). p -значение Отсечка Бонферрони использовалась для выбора сильных корреляций. Отрицательные оценки NS представляют отрицательные корреляции. (A) Межкоролевские (211) корреляции; (B) Эукариотические (375) корреляции, красные столбцы представляют положительные корреляции гриб/гриб и гриб/протисты; (C) Бактериальные (422) корреляции.
Отрицательные оценки NS представляют отрицательные корреляции. (A) Межкоролевские (211) корреляции; (B) Эукариотические (375) корреляции, красные столбцы представляют положительные корреляции гриб/гриб и гриб/протисты; (C) Бактериальные (422) корреляции.
Сеть совместной встречаемости в насыпных и ризосферных почвенных сообществах
Аналогичным образом мы создали подсети совместного присутствия, рассмотрев бактериальные и эукариотические сообщества в (i) объемной и ризосферной почве (связанной с почвой) (рис. 5) и (ii) ризосферных и корневых (связанных с корнем) микробиомах (рис. 6). ).В сети были обнаружены два микробных кластера с учетом связанной с почвой микробиоты (рис. 3). Кластер B1 был занят Eukaryotes Metazoa , Hacrobia , Alveolata , и Radiolaria и BACTERIA Accialobacteria , Actinobacteria , Bacterointetes , и протеабактерии . Этих таксонов было больше в ризосфере по сравнению с основной почвой (дополнительная фигура S7B). Восемьдесят процентов эукариотических и 86% бактериальных таксонов, обнаруженных в этом кластере, также были обнаружены в кластерах A1 и A2 в сети, основанной на микробных сообществах во всех нишах окружающей среды (рис. 3).В среднем, таксоны, обнаруженные в кластере B2 в сети, с учетом связанного с почвой микробиома, были более распространены в основной почве по сравнению с ризосферой, и многие из таксонов, обнаруженных в этом кластере (рис. 5), были также обнаружены в кластере A3, учитывая микробиом. сообщества во всех экологических нишах (рис. 3). Грибы также были частью кластера B2 в сети, рассматривающей насыпную и ризосферную почву.
Восемьдесят процентов эукариотических и 86% бактериальных таксонов, обнаруженных в этом кластере, также были обнаружены в кластерах A1 и A2 в сети, основанной на микробных сообществах во всех нишах окружающей среды (рис. 3).В среднем, таксоны, обнаруженные в кластере B2 в сети, с учетом связанного с почвой микробиома, были более распространены в основной почве по сравнению с ризосферой, и многие из таксонов, обнаруженных в этом кластере (рис. 5), были также обнаружены в кластере A3, учитывая микробиом. сообщества во всех экологических нишах (рис. 3). Грибы также были частью кластера B2 в сети, рассматривающей насыпную и ризосферную почву.
РИСУНОК 5. Сеть совместной встречаемости, созданная путем измерения кокорреляции обилия микробных таксонов из корней и ризосферы и насыпной почвы.Анализ корреляционной базы, показывающий потенциальное взаимодействие между родами бактерий, грибков и простейших. Размер узла пропорционален средней относительной численности таксона во всех выборках. Линии, соединяющие узлы (ребра), представляют положительное (синее) или отрицательное (красное) отношение совпадения. Интенсивность цвета и длина краев представляют силу корреляции. Таксоны, показанные на рисунке, являются центральными таксонами, которые были идентифицированы как те, которые были значительно более центральными на основе измерений степени, центральности по промежуточности и центральности по близости ( p > 0.1 на основе подгонки нормального распределения). Таксоны, выделенные жирным шрифтом, были обнаружены как центральные таксоны, по крайней мере, в двух сетях совместной встречаемости на основе обилия микроорганизмов, сгруппированных на уровне рода, семейства или отряда.
Линии, соединяющие узлы (ребра), представляют положительное (синее) или отрицательное (красное) отношение совпадения. Интенсивность цвета и длина краев представляют силу корреляции. Таксоны, показанные на рисунке, являются центральными таксонами, которые были идентифицированы как те, которые были значительно более центральными на основе измерений степени, центральности по промежуточности и центральности по близости ( p > 0.1 на основе подгонки нормального распределения). Таксоны, выделенные жирным шрифтом, были обнаружены как центральные таксоны, по крайней мере, в двух сетях совместной встречаемости на основе обилия микроорганизмов, сгруппированных на уровне рода, семейства или отряда.
РИСУНОК 6. Сеть совпадений, созданная путем измерения кокорреляции обилия микробных таксонов из корня и ризосферы. Анализ корреляционной базы, показывающий потенциальное взаимодействие между родами бактерий, грибков и простейших. Размер узла пропорционален средней относительной численности таксона во всех выборках. Линии, соединяющие узлы (ребра), представляют положительное (синее) или отрицательное (красное) отношение совпадения. Интенсивность цвета и длина краев представляют силу корреляции. Таксоны, показанные на рисунке, являются центральными таксонами, которые были идентифицированы как те, которые были значительно более центральными на основе измерений степени, центральности по промежуточности и центральности по близости ( p > 0,1 на основе подгонки нормального распределения). Таксоны, выделенные жирным шрифтом, были обнаружены как центральные таксоны, по крайней мере, в двух сетях совместной встречаемости на основе обилия микроорганизмов, сгруппированных на уровне рода, семейства или отряда.
Линии, соединяющие узлы (ребра), представляют положительное (синее) или отрицательное (красное) отношение совпадения. Интенсивность цвета и длина краев представляют силу корреляции. Таксоны, показанные на рисунке, являются центральными таксонами, которые были идентифицированы как те, которые были значительно более центральными на основе измерений степени, центральности по промежуточности и центральности по близости ( p > 0,1 на основе подгонки нормального распределения). Таксоны, выделенные жирным шрифтом, были обнаружены как центральные таксоны, по крайней мере, в двух сетях совместной встречаемости на основе обилия микроорганизмов, сгруппированных на уровне рода, семейства или отряда.
Сеть совместной встречаемости в ризосфере и корневых сообществах
Сеть, учитывающая кокорреляцию обилия в связанном с корнем микробиоме, продемонстрировала поразительную сложность (рис. 6). В сети были обнаружены один сильно взаимосвязанный кластер (кластер C1) и слабо связанные между собой кластеры C4. Кластер C1 был в основном занят эукариотами, некоторые из которых были в основном связаны с водной средой. В кластере также обнаружены водные бактерии Planctomycetes и Acidobacteria .Кластер C1 имел отрицательную корреляцию с Bradyrhizobiaceae и Pezizomycotina — основными таксонами, составляющими кластер C2. Оба царства из кластера C1 были более распространены в ризосфере по сравнению с корнем (дополнительная фигура S7C), а в кластере C2 была обнаружена обратная тенденция. Кластер C3 включал хищников Filosa Sarcomonadea , Metazoa ( Arthropoda , Nematoda и Rotifera ) и Alveolata , а также несколько потенциальных паразитических грибов.Кластеры С4 и С5 в основном представлены бактериями.
Кластер C1 был в основном занят эукариотами, некоторые из которых были в основном связаны с водной средой. В кластере также обнаружены водные бактерии Planctomycetes и Acidobacteria .Кластер C1 имел отрицательную корреляцию с Bradyrhizobiaceae и Pezizomycotina — основными таксонами, составляющими кластер C2. Оба царства из кластера C1 были более распространены в ризосфере по сравнению с корнем (дополнительная фигура S7C), а в кластере C2 была обнаружена обратная тенденция. Кластер C3 включал хищников Filosa Sarcomonadea , Metazoa ( Arthropoda , Nematoda и Rotifera ) и Alveolata , а также несколько потенциальных паразитических грибов.Кластеры С4 и С5 в основном представлены бактериями.
Идентификация узловых таксонов в микробных сетях
Для идентификации центральных микробов мы создали сети совпадений, основанные на сильных корреляциях с p -значениями <0,01, 0,001, 0,0001 и пороговыми значениями Бонферрони для микробных таксонов, сгруппированных на уровне рода, семейства или отряда. Было создано 12 сетей для каждого из 3 типов сообществ: (i) во всех экологических нишах, (ii) связанных с основной и ризосферной почвой и (iii) связанных с ризосферой и корнями растений.Были использованы множественные значения p , поскольку ранее было показано, что сила отсечения влияет на структуру сети (Kurtz et al., 2015). Точно так же в нашем анализе мы обнаружили различия в параметрах узлов из сетей, основанных на различных пороговых значениях p . Для каждой сети мы определили узлы со значительно более высокой степенью центральности по промежуточности или центральности по близости на основе подгонки нормального распределения с p <0,1 для всех трех параметров с использованием по крайней мере двух из четырех отсечений корреляции.Эти узлы рассматривались как потенциальные выбросы.
Было создано 12 сетей для каждого из 3 типов сообществ: (i) во всех экологических нишах, (ii) связанных с основной и ризосферной почвой и (iii) связанных с ризосферой и корнями растений.Были использованы множественные значения p , поскольку ранее было показано, что сила отсечения влияет на структуру сети (Kurtz et al., 2015). Точно так же в нашем анализе мы обнаружили различия в параметрах узлов из сетей, основанных на различных пороговых значениях p . Для каждой сети мы определили узлы со значительно более высокой степенью центральности по промежуточности или центральности по близости на основе подгонки нормального распределения с p <0,1 для всех трех параметров с использованием по крайней мере двух из четырех отсечений корреляции.Эти узлы рассматривались как потенциальные выбросы.
В сетях было выявлено несколько потенциальных выбросов, учитывающих микробные сообщества во всех экологических нишах и основанных на различной группировке таксонов (дополнительная таблица S2). Роды бактерий Bradyrhizobiaceae и Pedosphaerales и грибы Pezizomycotina , Geoglossomycetes и Leotiomycetes были тесно связаны (рис. 3). Объединенные вместе, эти четыре микробных таксона были непосредственно связаны с 30 эукариотическими и 34 бактериальными таксонами, которые представляли 67% всех узлов в сети на основе корреляций с p -значениями с порогами Бонферрони. Bradyrhizobium и Pedosphaerales поддерживались на всех таксономических уровнях (рисунок 3 и дополнительные рисунки S6A, B) и были напрямую связаны с 21 (43%) эукариотным и 29 (62%) бактериальным таксоном, сгруппированными на уровне родов, на основе корреляций. с p -значения с отсечкой Бонферрони. В сети совместной встречаемости, учитывающей связанный с почвой микробиом и основанной на микробных таксонах, сгруппированных на уровне родов, эукариотических таксонов Dinophyceae , Telonemia , Maxillopoda и Appendicularia и бактериальных таксонов Acidobacteriace и Pedosphaerales были тесно связаны между собой.
Роды бактерий Bradyrhizobiaceae и Pedosphaerales и грибы Pezizomycotina , Geoglossomycetes и Leotiomycetes были тесно связаны (рис. 3). Объединенные вместе, эти четыре микробных таксона были непосредственно связаны с 30 эукариотическими и 34 бактериальными таксонами, которые представляли 67% всех узлов в сети на основе корреляций с p -значениями с порогами Бонферрони. Bradyrhizobium и Pedosphaerales поддерживались на всех таксономических уровнях (рисунок 3 и дополнительные рисунки S6A, B) и были напрямую связаны с 21 (43%) эукариотным и 29 (62%) бактериальным таксоном, сгруппированными на уровне родов, на основе корреляций. с p -значения с отсечкой Бонферрони. В сети совместной встречаемости, учитывающей связанный с почвой микробиом и основанной на микробных таксонах, сгруппированных на уровне родов, эукариотических таксонов Dinophyceae , Telonemia , Maxillopoda и Appendicularia и бактериальных таксонов Acidobacteriace и Pedosphaerales были тесно связаны между собой.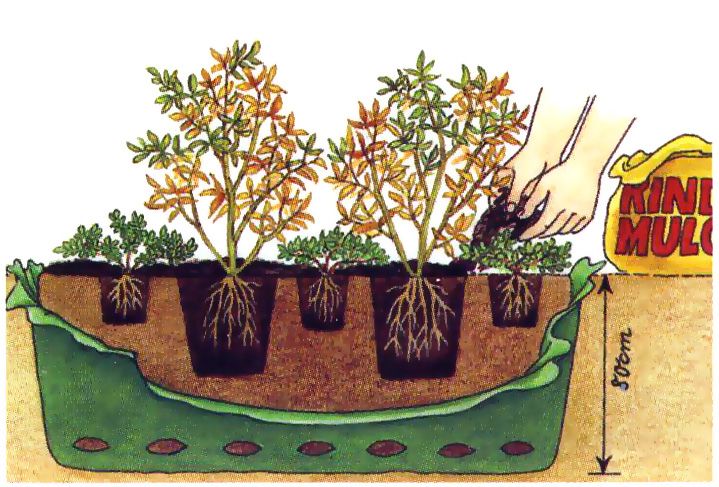 Acidobacteriaceae , Caulobacteraceae также были обнаружены в качестве центральных таксонов, по крайней мере, в одной другой сети совместного появления на основе другой группировки (дополнительная таблица S3 и рисунок 5). Учитывая корневым микробием, Bradyrizobiaceae , солибактериалы , Pedospacterales , Pedosphaerales , и грибы Pezizomycotina Leootiomycetes были идентифицированы как концентраторные таксоны, по меньшей мере, в не менее двух сетях соположения (дополнительная таблица S4 и рисунок 6 ).
Acidobacteriaceae , Caulobacteraceae также были обнаружены в качестве центральных таксонов, по крайней мере, в одной другой сети совместного появления на основе другой группировки (дополнительная таблица S3 и рисунок 5). Учитывая корневым микробием, Bradyrizobiaceae , солибактериалы , Pedospacterales , Pedosphaerales , и грибы Pezizomycotina Leootiomycetes были идентифицированы как концентраторные таксоны, по меньшей мере, в не менее двух сетях соположения (дополнительная таблица S4 и рисунок 6 ).
Обсуждение
Концепция холобионта охватывает сложную сеть функций и симбиотических взаимодействий между растением-хозяином и его микробиомом. За последние несколько лет значительно расширилось понимание бактериальных и грибковых сообществ как компонентов холобионта и их роли в поглощении растениями питательных веществ и устойчивости к биотическим и абиотическим стрессам (Vandenkoornhuyse et al., 2015). Однако для полного понимания концепции холобионтов растений не хватает объяснения того, как негрибковые эукариотические микроорганизмы вписываются в эту сложную сеть взаимодействий растений и микробиомов. Чтобы выяснить роль почвенных эукариот и прокариот в растительном микробиоме, мы исследовали микробиом корней дикой черники, содержащий 996 эукариотических и 6802 бактериальных OTU соответственно. Это сообщество состояло в основном из эндофитов с возможной незначительной долей корнево-эпифитных микроорганизмов. Микробиом был объединен с ранее идентифицированными основными микробиомами почвы и ризосферы (Yurgel et al., 2017), в результате чего было получено в общей сложности 530 грибковых, 1201 негрибковая эукариотическая и 8058 бактериальных OTU во всех экологических нишах.Этот всеобъемлющий набор данных позволил нам оценить роль негрибковых эукариот в формировании взаимодействий между растениями черники и почвенными микробами.
Чтобы выяснить роль почвенных эукариот и прокариот в растительном микробиоме, мы исследовали микробиом корней дикой черники, содержащий 996 эукариотических и 6802 бактериальных OTU соответственно. Это сообщество состояло в основном из эндофитов с возможной незначительной долей корнево-эпифитных микроорганизмов. Микробиом был объединен с ранее идентифицированными основными микробиомами почвы и ризосферы (Yurgel et al., 2017), в результате чего было получено в общей сложности 530 грибковых, 1201 негрибковая эукариотическая и 8058 бактериальных OTU во всех экологических нишах.Этот всеобъемлющий набор данных позволил нам оценить роль негрибковых эукариот в формировании взаимодействий между растениями черники и почвенными микробами.
Эукариотическое сообщество
Как и в предыдущих отчетах (Leach et al., 2017), грибы были наиболее распространенными таксонами эукариот в микробиоме корня дикой черники. Эти грибы включали ряд потенциальных таксонов микоризных грибов, таких как Pezizomycotina, Glomeromycota , Mucoromycotina и Chytridiomycota (Kohout et al. , 2012; Дэвисон и др., 2015; ван дер Хейден и др., 2015 г.; Orchard et al., 2017), предполагаемые эрикоидные микоризные грибы Lachnum (Walker et al., 2011; Bizabani and Dames, 2015; Zhang et al., 2016) и потенциально стимулирующий рост растений эндофит Phialocephala (Rodriguez et al. ., 2009; Лукесова и др., 2015; Schlegel et al., 2016). Нам удалось идентифицировать 30, 12, 7 и 6 отдельных OTU, принадлежащих Cercozoa , Nematoda , Annelida и Arthropoda соответственно.В целом эти микроорганизмы были представлены примерно 12% высококачественных прочтений 18S и были наиболее распространенными негрибковыми эукариотами в микробиоме корней.
, 2012; Дэвисон и др., 2015; ван дер Хейден и др., 2015 г.; Orchard et al., 2017), предполагаемые эрикоидные микоризные грибы Lachnum (Walker et al., 2011; Bizabani and Dames, 2015; Zhang et al., 2016) и потенциально стимулирующий рост растений эндофит Phialocephala (Rodriguez et al. ., 2009; Лукесова и др., 2015; Schlegel et al., 2016). Нам удалось идентифицировать 30, 12, 7 и 6 отдельных OTU, принадлежащих Cercozoa , Nematoda , Annelida и Arthropoda соответственно.В целом эти микроорганизмы были представлены примерно 12% высококачественных прочтений 18S и были наиболее распространенными негрибковыми эукариотами в микробиоме корней.
Бактериальное сообщество
Ранее было показано, что бактерии, принадлежащие к трем основным типам, Proteobacteria, Actinobacteria и Bacteroidetes , являются наиболее распространенными таксонами в ризосфере и эндосфере растений, в то время как тип Acidobacteria часто исключается из этих компартментов ( Хаккард и др. , 2015; Лич и др., 2017). Точно так же Alphaproteobacteria и Gammaproteobacteria, Actinobacteria и Bacteroidetes были среди пяти наиболее распространенных бактериальных таксонов в корнях дикой черники и были обогащены вдоль континуума почва-эндосфера. Хотя Acidobacteria был вторым наиболее распространенным типом в корневом микробиоме, его численность была значительно ниже в корнях по сравнению с ризосферой. Сообщалось об исключении Acidobacteria из эндофитного компартмента в микробиомах других растений (Bulgarelli et al., 2013).
, 2015; Лич и др., 2017). Точно так же Alphaproteobacteria и Gammaproteobacteria, Actinobacteria и Bacteroidetes были среди пяти наиболее распространенных бактериальных таксонов в корнях дикой черники и были обогащены вдоль континуума почва-эндосфера. Хотя Acidobacteria был вторым наиболее распространенным типом в корневом микробиоме, его численность была значительно ниже в корнях по сравнению с ризосферой. Сообщалось об исключении Acidobacteria из эндофитного компартмента в микробиомах других растений (Bulgarelli et al., 2013).
Переход микробиома вдоль почвенно-эндосферного континуума
Основной почвенный микробиом служит основой для микробиома, связанного с растениями (Shakya et al., 2013; Schreiter et al., 2014). В соответствии с этим представлением более 52% эукариотических и 80% бактериальных OTU, выявленных в этом исследовании, обнаруживаются во всех трех экологических нишах, в то время как только 1% OTU были уникальными для связанного с корнем микробиома. Ризосфера является первой средой обитания с сильным растительным влиянием на микробные сообщества.Однако переход от поверхности корня к внутренней части обеспечивает сильнейший эффект сортировки видов, требуя специализации микробов, необходимой для инвазии и выживания внутри растительной ткани, и, как следствие, значительное снижение разнообразия сообщества (Hacquard et al., 2015; Vandenkoornhuyse et al. ., 2015). Наши данные также указывают на значительное снижение бактериального и эукариотического разнообразия в корневом микробиоме по сравнению с ризосферой и основной почвой, вероятно, в результате этого процесса специализации.
Ризосфера является первой средой обитания с сильным растительным влиянием на микробные сообщества.Однако переход от поверхности корня к внутренней части обеспечивает сильнейший эффект сортировки видов, требуя специализации микробов, необходимой для инвазии и выживания внутри растительной ткани, и, как следствие, значительное снижение разнообразия сообщества (Hacquard et al., 2015; Vandenkoornhuyse et al. ., 2015). Наши данные также указывают на значительное снижение бактериального и эукариотического разнообразия в корневом микробиоме по сравнению с ризосферой и основной почвой, вероятно, в результате этого процесса специализации.
Как сообщалось ранее в образцах ризосферы дикой голубики, сортировка видов под влиянием растений оказывает более сильное влияние на бактерии, чем на эукариоты (Yurgel et al., 2017). Здесь мы обнаружили противоположный эффект сортировки видов в корневом микробиоме. Меньшая доля эукариотических OTU, чем бактериальных OTU, была общей для всех трех сред. Более того, 15 наиболее распространенных эукариот в корнях имели значительно более низкую относительную численность в двух других средах, чего нельзя было сказать о наиболее распространенных в корнях бактериях. В соответствии с этим выводом, ниша (ризосфера по сравнению с корнем) коррелирует с 23% изменчивости эукариотического и 17% бактериального сообщества. Специфический эффект сортировки видов в корневом микробиоме по хозяину привел к увеличению относительной численности грибов, адаптированных к растительно-ассоциированному образу жизни, таких как Lachnum , Phialocephala и Sordariomycete s, а также лишайников. грибы-образователи Lecanorales , Cetradonia linearis и Cladonia .Напротив, относительная численность микроскопических животных, протистов и водорослей была снижена вдоль континуума почва-эндосфера в корне, вероятно, из-за сильного влияния системы защиты хозяина на создание сообщества и низкой адаптации негрибных эукариот к защите растения-хозяина. ответы.
Связь между производством полевых фруктов и структурой сообщества
Поскольку у нас не было подробной информации об урожайности плодов на управляемых полях, используемых в качестве мест отбора проб, мы присвоили каждому полю параметр высокой или низкой урожайности плодов на основе оценки полевой продукции производителями голубики. Наши данные показали незначительную, но статистически значимую корреляцию между продуктивностью полевых плодов и структурой эукариотического сообщества. В частности, мы обнаружили, что паразитические грибы Cryptomycotina (Letcher et al., 2017), планирующие бактериоядные/водоросли Glissomonadida ( Cercozoa ) (Howe et al., 2009) и Rhizaria () Hess, 2017) были более многочисленны на полях с низкой урожайностью во всех трех экологических нишах.Присутствие этих микроорганизмов может прямо или косвенно влиять на здоровье растений посредством развития болезней и/или истощения микробных таксонов, оказывая благотворное влияние на развитие и продуктивность растений. Однако для проверки этой гипотезы необходимы более детальные исследования, включающие в себя обследование полей и увеличение количества точек отбора проб для лучшего разрешения различий в структуре микробиомов.
Наши данные показали незначительную, но статистически значимую корреляцию между продуктивностью полевых плодов и структурой эукариотического сообщества. В частности, мы обнаружили, что паразитические грибы Cryptomycotina (Letcher et al., 2017), планирующие бактериоядные/водоросли Glissomonadida ( Cercozoa ) (Howe et al., 2009) и Rhizaria () Hess, 2017) были более многочисленны на полях с низкой урожайностью во всех трех экологических нишах.Присутствие этих микроорганизмов может прямо или косвенно влиять на здоровье растений посредством развития болезней и/или истощения микробных таксонов, оказывая благотворное влияние на развитие и продуктивность растений. Однако для проверки этой гипотезы необходимы более детальные исследования, включающие в себя обследование полей и увеличение количества точек отбора проб для лучшего разрешения различий в структуре микробиомов.
Ранее мы показали, что совокупная разница в лесах и . управляемых систем влияли на бактериальные сообщества в ризосферах черники, но в меньшей степени на эукариотические сообщества (Юргель и др. , 2017). Аналогичная тенденция более сильного воздействия обработки на бактериальные сообщества по сравнению с эукариотическими сообществами была обнаружена в корнях голубики. Основными факторами, участвующими в дифференциации микробного сообщества между управляемыми и естественными средами обитания, могут быть предыдущая обрезка растений, использование почвенных удобрений и методы борьбы с вредителями, что привело к более высоким темпам роста и продуктивности управляемых насаждений по сравнению с лесными насаждениями. (Юргель и др., 2017).
, 2017). Аналогичная тенденция более сильного воздействия обработки на бактериальные сообщества по сравнению с эукариотическими сообществами была обнаружена в корнях голубики. Основными факторами, участвующими в дифференциации микробного сообщества между управляемыми и естественными средами обитания, могут быть предыдущая обрезка растений, использование почвенных удобрений и методы борьбы с вредителями, что привело к более высоким темпам роста и продуктивности управляемых насаждений по сравнению с лесными насаждениями. (Юргель и др., 2017).
Корреляционные сети сообщества
Для дальнейшей оценки правил, регулирующих сборку связанной с растениями микробиоты, мы создали корреляционные сети бактериальных и эукариотических сообществ, которые включали различные уровни влияния растения-хозяина. В этой модели считалось, что объединенные объемные и ризосферные сообщества (связанный с почвой микробиом) находятся под меньшим влиянием растений по сравнению с объединенными ризосферными и корневыми сообществами (связанный с корнями микробиом). Объединение микробных сообществ во всех экологических нишах в единую корреляционную сеть обеспечило дополнительное представление о взаимодействии микроб-микроб и растение-микроб в более широкой экологической обстановке. Предыдущие исследования показали, что бактериальная сеть более сложна в микробиоме, связанном с корнями, чем в основной почве (Cordero and Datta, 2016; Shi et al., 2016). Мы также обнаружили, что микробная сеть, включающая как бактериальные, так и эукариотические микроорганизмы, стала более сложной в континууме почва-эндосфера.В сети совместного присутствия, связанной с почвой, появилось только два визуально четко определенных кластера, в то время как в сети совместного присутствия, связанной с корнями, появилось четыре слабо связанных кластера и один тесно связанный кластер.
Объединение микробных сообществ во всех экологических нишах в единую корреляционную сеть обеспечило дополнительное представление о взаимодействии микроб-микроб и растение-микроб в более широкой экологической обстановке. Предыдущие исследования показали, что бактериальная сеть более сложна в микробиоме, связанном с корнями, чем в основной почве (Cordero and Datta, 2016; Shi et al., 2016). Мы также обнаружили, что микробная сеть, включающая как бактериальные, так и эукариотические микроорганизмы, стала более сложной в континууме почва-эндосфера.В сети совместного присутствия, связанной с почвой, появилось только два визуально четко определенных кластера, в то время как в сети совместного присутствия, связанной с корнями, появилось четыре слабо связанных кластера и один тесно связанный кластер.
Существование обширных мутуалистических взаимодействий между микроорганизмами, связанными с растениями, является хорошо известной концепцией (Hallam and McCutcheon, 2015). Ранее в царствах микроорганизмов, ассоциированных с растениями, обнаруживались более положительные, чем отрицательные корреляции, тогда как между микробами из разных царств обнаруживались более отрицательные, чем положительные корреляции (Agler et al. , 2016). Наши данные показали более равномерное распределение положительных и отрицательных корреляций внутри царств, предполагая, что совместное исключение или конкуренция также играют важную роль в формировании связанных с растениями микробиомов. Предыдущее исследование корреляций между царствами показало, что почвенные протисты образуют отдельные кластеры, которые связывают ряд таксонов бактерий и грибов (Xiong et al., 2017). Во всех сетях, построенных в этом исследовании, были идентифицированы тесно связанные кластеры, включающие как бактериальные, так и эукариотические организмы.Более того, между микробами из разных царств была обнаружена более высокая доля положительных корреляций по сравнению с отрицательными, что подчеркивает важность мутуалистических взаимодействий в межцарственных сетях.
, 2016). Наши данные показали более равномерное распределение положительных и отрицательных корреляций внутри царств, предполагая, что совместное исключение или конкуренция также играют важную роль в формировании связанных с растениями микробиомов. Предыдущее исследование корреляций между царствами показало, что почвенные протисты образуют отдельные кластеры, которые связывают ряд таксонов бактерий и грибов (Xiong et al., 2017). Во всех сетях, построенных в этом исследовании, были идентифицированы тесно связанные кластеры, включающие как бактериальные, так и эукариотические организмы.Более того, между микробами из разных царств была обнаружена более высокая доля положительных корреляций по сравнению с отрицательными, что подчеркивает важность мутуалистических взаимодействий в межцарственных сетях.
Идентификация узловых таксонов в микробных сетях
Во всех экологических нишах бактерии Bradyrhizobium и Pedosphaerales и грибы Pezizomycotina Geoglossomycetes и Leotiomycetes были идентифицированы как центральные таксоны почвы, что свидетельствует о важной роли этих микроорганизмов в дикой голубике.
Hub Taxa в растительном микробиоме
Bradyrhizobium, Pedosphaerales и Leotiomycetes также были центрами в сети с учетом микробиома корневых ассоциатов. Недавно была проверена способность некоторых сильно взаимосвязанных микробных таксонов связывать факторы хозяина с вариациями микробиома растений (Agler et al., 2016). Род Bradyrhizobium является одним из самых распространенных микроорганизмов в почвах со всего мира и играет решающую роль в плодородии почвы.Эти бактерии использовались в качестве модельного организма для изучения влияния факторов окружающей среды на микробиоту почвы (Shah and Subramaniam, 2017). Организмы рода Bradyrhizobium способны стимулировать рост растений, продуцируя соединения, стимулирующие рост растений, индол-3-уксусную кислоту и дезаминазу 1-аминоциклопропан-1-карбоновой кислоты, а также фиксировать азот внутри тканей растений (Piromyou et al. др., 2017). Род Leotiomycetes содержит множество патогенов растений и микоризных грибов (Glawe, 2008; Walker et al. , 2011; Bizabani and Dames, 2015) и, следовательно, может оказывать сильное влияние на здоровье почвы и растений и, как следствие, на микробиомы, связанные с этими нишами. Actinobacteria Actinomycetales и Acidobacteria Solibacterales также были идентифицированы как концентраторы в корневом микробиоме. Актинобактерии являются одним из наиболее распространенных таксонов в ризосфере и эндосфере растений (Hacquard et al., 2015; Leach et al., 2017) и играют важную роль в плодородии почвы и здоровье растений. Актиномицеты способны улучшить доступность питательных веществ и минералов в почве, подавить некоторые патогены и улучшить здоровье растений (Bhatti et al., 2017).
, 2011; Bizabani and Dames, 2015) и, следовательно, может оказывать сильное влияние на здоровье почвы и растений и, как следствие, на микробиомы, связанные с этими нишами. Actinobacteria Actinomycetales и Acidobacteria Solibacterales также были идентифицированы как концентраторы в корневом микробиоме. Актинобактерии являются одним из наиболее распространенных таксонов в ризосфере и эндосфере растений (Hacquard et al., 2015; Leach et al., 2017) и играют важную роль в плодородии почвы и здоровье растений. Актиномицеты способны улучшить доступность питательных веществ и минералов в почве, подавить некоторые патогены и улучшить здоровье растений (Bhatti et al., 2017).
Hub Taxa в связанном с почвой микробиоме
В сети, учитывая изобилие соотражающуюся соотношением в почве, связанные с почвенным микробием, без грибковых эукариотических таксонов Dinophyceae , TeloneMia , AppEdlopoda , и AppEndicularian и бактериальные таксоны Acidobacteriaceae , Caulobacteraceae , и были идентифицированы как концентраторы. Acidobacteria , является одним из наиболее распространенных таксонов бактерий в почвах, особенно в кислых условиях, которые, по прогнозам, участвуют в круговороте питательных веществ в почве (Kielak et al., 2016). Сообщалось об экологических взаимодействиях Acidobacteria с Proteobacteria (Kielak et al., 2016) и с почвенными простейшими (Xiong et al., 2017). В то время как недавно было показано, что Dinophyceae является важным членом сообществ почвенных протистанов (Bates et al., 2013; Yurgel et al., 2017), мало что известно о роли Telonemia , Maxillopoda и Appendicularia в почвенном микробиоме. Таким образом, наши результаты подчеркивают сложность экологии почвы и необходимость дополнительных исследований, направленных на понимание взаимодействия между царствами в сообществах, связанных с почвой и растениями.
Acidobacteria , является одним из наиболее распространенных таксонов бактерий в почвах, особенно в кислых условиях, которые, по прогнозам, участвуют в круговороте питательных веществ в почве (Kielak et al., 2016). Сообщалось об экологических взаимодействиях Acidobacteria с Proteobacteria (Kielak et al., 2016) и с почвенными простейшими (Xiong et al., 2017). В то время как недавно было показано, что Dinophyceae является важным членом сообществ почвенных протистанов (Bates et al., 2013; Yurgel et al., 2017), мало что известно о роли Telonemia , Maxillopoda и Appendicularia в почвенном микробиоме. Таким образом, наши результаты подчеркивают сложность экологии почвы и необходимость дополнительных исследований, направленных на понимание взаимодействия между царствами в сообществах, связанных с почвой и растениями.
Заключение
Наш анализ эукариотических и бактериальных сообществ, связанных с экосистемами дикой голубики, позволил нам лучше понять эффект сортировки видов под влиянием растений на почвенные бактерии и грибы, а также получить представление о влиянии этого процесса на негрибковые эукариоты. Это исследование также расширяет наши знания о влиянии совокупных различий между лесными и управляемыми системами на микробные сообщества и выявило несколько эукариотических таксонов, которые потенциально связаны со снижением производства фруктов в сельскохозяйственных экосистемах дикой черники. Наши данные показали, что бактериальные и эукариотические взаимодействия становятся более сложными в континууме почва-эндосфера и включают обширное мутуалистическое межцарствование. Мы также определили несколько потенциальных центральных таксонов, играющих важную роль в плодородии почвы и/или взаимодействии растений и микробов, и указали на потенциальную роль этих таксонов во взаимосвязи между почвами и здоровьем растений и общей структурой микробного сообщества.
Вклад авторов
SY и ML получили финансирование. SY и DP разработали исследование и собрали образцы. SY и AD обработали образцы и выполнили предварительную обработку данных. SY выполнил биоинформатический анализ и написал рукопись. GD помогал с анализом биоинформатики. SY, ML и DP проанализировали и обсудили результаты. SY, GD, ML и DP участвовали в подготовке и окончательной версии рукописи.
GD помогал с анализом биоинформатики. SY, ML и DP проанализировали и обсудили результаты. SY, GD, ML и DP участвовали в подготовке и окончательной версии рукописи.
Финансирование
Эта работа была поддержана грантом Новой Шотландии на ускорение исследований RA2016-005, грантом Discovery от Совета по естественным наукам и инженерным исследованиям Канады и Ассоциации производителей дикой голубики Новой Шотландии для SY.Дополнительная поддержка была оказана ML через Фонд стратегических исследовательских инициатив Университета Далхаузи и грант Discovery от Совета по естественным наукам и инженерным исследованиям Канады.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Дополнительный материал
Дополнительный материал к этой статье можно найти в Интернете по адресу: https://www. frontiersin.org/articles/10.3389/fmicb.2018.01187/full#supplementary-material
frontiersin.org/articles/10.3389/fmicb.2018.01187/full#supplementary-material
Сноска
- http://cgeb-imr.ca/
Каталожные номера
Agler, M.T., Ruhe, J., Kroll, S., Morhenn, C., Kim, S.T., Weigel, D., et al. (2016). Таксоны микробного хаба связывают хозяина и абиотические факторы с вариациями микробиома растений. PLoS Биол. 14:e1002352. doi: 10.1371/journal.pbio.1002352
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Бейтс, С.T., Clemente, J.C., Flores, G.E., Walters, W.A., Parfrey, L.W., Knight, R., et al. (2013). Глобальная биогеография весьма разнообразных сообществ протистов в почве. ISME J. 7, 652–659. doi: 10.1038/ismej.2012.147
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Белл, Д. Дж., Роуленд, Л. Дж., Чжан, Д., и Драммонда, Ф. А. (2009). Пространственная генетическая структура голубики низкорослой, Vaccinium angustifolium , на четырех полях в штате Мэн. Ботаника 87, 932–946.doi: 10.1094/PHYTO-02-16-0093-R
Ботаника 87, 932–946.doi: 10.1094/PHYTO-02-16-0093-R
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Бизабани, К., и Дамес, Дж. (2015). Влияние инокуляции изолятов Lachnum и Cadophora на рост Vaccinium corymbosum . Микробиолог. Рез. 181, 68–74. doi: 10.1016/j.micres.2015.08.005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Булгарелли, Д., Шлеппи, К., Шпепен, С., Вер Лорен ван Темаат, Э.и Шульце-Леферт, П. (2013). Структура и функции бактериальной микробиоты растений. год. Преподобный завод биол. 64, 807–838. doi: 10.1146/annurev-arplant-050312-120106
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Басби, П.Е., Зоман, К., Вагнер, М.Р., Фризен, М.Л., Кремер, Дж., Беннетт, А., и соавт. (2017). Приоритеты исследований для использования растительных микробиомов в устойчивом сельском хозяйстве. PLoS Биол. 15:e2001793. doi: 10.1371/журнал.pbio.2001793
doi: 10.1371/журнал.pbio.2001793
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Бушнелл, Б. (2014). BBMap: быстрый и точный выравниватель с поддержкой сварки. Технический отчет LBNL-7065E. Беркли, Калифорния: Ernest Orlando Lawrence Berkeley Natl Lab.
Академия Google
Caporaso, J.G., Kuczynski, J., Stombaugh, J., Bittinger, K., Bushman, F.D., Costello, E.K., et al. (2010). QIIME позволяет анализировать данные секвенирования с высокой пропускной способностью. Нац. Методы 7, 335–336.
Академия Google
Комо, А. М., Дуглас, Г. М., и Лангилл, М. Г. (2017). Помощник микробиома: настраиваемый и оптимизированный рабочий процесс для исследования микробиома. mSystems 2:e00127-16. doi: 10.1128/mSystems.00127-16
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Комо, А. М., Винсент, В. Ф., Бернье, Л., и Лавджой, К. (2016). Новые линии хитридов доминируют в последовательностях грибов в разнообразных морских и пресноводных местообитаниях. науч.Респ. 6:30120. дои: 10.1038/srep30120
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дэвисон Дж., Мура М., Опик М., Адхолея А., Айнсаар Л., Ба А. и соавт. (2015). ГРИБНЫЕ СИМБИОНТЫ. Глобальная оценка разнообразия арбускулярных микоризных грибов показывает очень низкий эндемизм. Наука 349, 970–973. doi: 10.1126/science.aab1161
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Драммонд Ф., Смагула Дж., Аннис С.и Ярборо, Д. (2009). Производство органической дикой черники. МАФЕС Бык. 852:43.
Академия Google
Eaton, LJ (1988). Круговорот питательных веществ в чернике низкорослых. Галифакс: Университет Далхаузи.
Академия Google
Эдгар, Р. К., Хаас, Б. Дж., Клементе, Дж. К., Айва, К., и Найт, Р. (2011). UCHIME повышает чувствительность и скорость обнаружения химер. Биоинформатика 27, 2194–2200. doi: 10.1093/биоинформатика/btr381
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Гейзен, С. (2016). Концепция бактериально-грибкового энергетического канала ставится под сомнение огромной функциональной универсальностью почвенных протистов. Почвенный биол. Биохим. 102, 22–25.
(2016). Концепция бактериально-грибкового энергетического канала ставится под сомнение огромной функциональной универсальностью почвенных протистов. Почвенный биол. Биохим. 102, 22–25.
Академия Google
Гейзен С., Розенгартен Дж., Коллер Р., Малдер К., Урих Т. и Бонковски М. (2015a). Стайная охота обыкновенной почвенной амебы на нематод. Окружающая среда. микробиол. 17, 4538–4546. дои: 10.1111/1462-2920.12949
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Гейзен, С., Tveit, A.T., Clark, I.M., Richter, A., Svenning, M.M., Bonkowski, M., et al. (2015б). Метатранскриптомный учет активных протистов в почвах. ISME J. 9, 2178–2190. doi: 10.1038/ismej.2015.30
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Геверс, Д., Кугатасан, С., Денсон, Л. А., Васкес-Баеза, Ю., Ван Треурен, В., Рен, Б., и другие. (2014). Нелеченный микробиом при впервые возникшей болезни Крона. Микроб-хозяин клетки 15, 382–392.doi: 10.1016/j.chom.2014.02.005
Микроб-хозяин клетки 15, 382–392.doi: 10.1016/j.chom.2014.02.005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Glawe, DA (2008). Мучнистая роса: обзор самых известных в мире (но малоизвестных) патогенов растений. год. Преподобный Фитопат. 46, 27–51. doi: 10.1146/annurev.phyto.46.081407.104740
Полнотекстовая перекрестная ссылка | Академия Google
Гроссманн Л., Дженсен М., Хайдер Д., Йост С., Глюксман Э., Хартикайнен Х. и соавт. (2016). Анализ сообщества протистов: основные результаты крупномасштабной молекулярной выборки. ISME J. 10, 2269–2279. doi: 10.1038/ismej.2016.10
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Hacquard, S., Garrido-Oter, R., Gonzalez, A., Spaepen, S., Ackermann, G., Lebeis, S., et al. (2015). Микробиота и питание хозяина в растительном и животном мире. Микроб-хозяин клетки 17, 603–616. doi: 10.1016/j.chom.2015.04.009
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Hall, I. V., Aalders, L.E., Nickerson, NL, and Vander Kloet, S.P. (1979). Биологическая флора Канады. I. Vaccinium angustifolium Ait., черника низкорослая сладкая. Канада. Полевой натуралист 93, 415–430.
V., Aalders, L.E., Nickerson, NL, and Vander Kloet, S.P. (1979). Биологическая флора Канады. I. Vaccinium angustifolium Ait., черника низкорослая сладкая. Канада. Полевой натуралист 93, 415–430.
Академия Google
Hallam, SJ, и McCutcheon, JP (2015). Микробы не играют в пасьянс: как сотрудничество побеждает изоляцию в микробном мире. Окружающая среда. микробиол. 7, 26–28.
Академия Google
Гесс, С. (2017). Охота на подвижную добычу: трофическая специализация лептофриидных амеб (Vampyrellida, Rhizaria), выявленная двумя новыми хищниками планктонных водорослей. FEMS микробиол. Экол. 93: исправление104. doi: 10.1093/femsec/fix104
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хоу А. Т., Басс Д., Викерман К., Чао Э. Э. и Кавалье-Смит Т. (2009). Филогения, таксономия и поразительное генетическое разнообразие Glissomonadida ord. nov., доминирующие планирующие зоофлагелляты в почве (Protozoa: Cercozoa). Протист 160, 159–189. doi: 10.1016/j.protis.2008.11.007
Протист 160, 159–189. doi: 10.1016/j.protis.2008.11.007
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Килак, А.М., Баррето, К.С., Ковальчук, Г.А., ван Вин, Дж.А., и Курамае, Э.Е. (2016). Экология Acidobacteria : выход за рамки генов и геномов. Фронт. микробиол. 7:744. doi: 10.3389/fmicb.2016.00744
Полнотекстовая перекрестная ссылка | Академия Google
Кохаут П., Сыкорова З., Цтвртликова М., Рыдлова Дж., Суда Дж., Вохник М. и соавт. (2012). Удивительные спектры корневых грибов в подводных водных растениях. FEMS микробиол. Экол. 80, 216–235.doi: 10.1111/j.1574-6941.2011.01291.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Копылова, Э., Ноэ, Л., и Тузе, Х. (2012). SortMeRNA: быстрая и точная фильтрация рибосомных РНК в метатранскриптомных данных. Биоинформатика 28, 3211–3217. doi: 10.1093/биоинформатика/bts611
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Kurtz, Z. D., Muller, C.L., Miraldi, E.R., Littman, D.R., Blaser, M.J., and Bonneau, R.А. (2015). Разреженный и композиционно надежный вывод о микробных экологических сетях. Вычисление PLoS. биол. 11:e1004226. doi: 10.1371/journal.pcbi.1004226
D., Muller, C.L., Miraldi, E.R., Littman, D.R., Blaser, M.J., and Bonneau, R.А. (2015). Разреженный и композиционно надежный вывод о микробных экологических сетях. Вычисление PLoS. биол. 11:e1004226. doi: 10.1371/journal.pcbi.1004226
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Летчер, П. М., Лонгкор, Дж. Э., Джеймс, Т. Ю., Лейте, Д. С., Симмонс, Д. Р., и Пауэлл, М. Дж. (2017). Морфология, ультраструктура и молекулярная филогения Rozella multimorpha , нового вида Cryptomycota. Дж. Эукариот. микробиол. 65, 180–190. doi: 10.1111/jeu.12452
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Лозупоне, К., Лладсер, М.Е., Найтс, Д., Стомбах, Дж., и Найт, Р. (2011). UniFrac: эффективная метрика расстояния для сравнения микробного сообщества. ISME J. 5, 169–172.
Реферат PubMed | Академия Google
Лукесова Т., Кохаут П., Ветровский Т. и Воник М. (2015). Потенциал темных септированных эндофитов к образованию корневых симбиозов с эктомикоризными и эрикоидно-микоризными среднеевропейскими лесными растениями. PLoS One 10:e0124752. doi: 10.1371/journal.pone.0124752
PLoS One 10:e0124752. doi: 10.1371/journal.pone.0124752
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Орчард, С., Хилтон, С., Бендинг, Г.Д., Дики, И.А., Стэндиш, Р.Дж., Глисон, Д.Б., и соавт. (2017). Мелкие эндофиты ( Glomus tenue ) относятся к Mucoromycotina, а не к Glomeromycota. Новый фитол. 213, 481–486.
Академия Google
Паркс, Д. Х., Тайсон, Г. В., Хугенхольц, П., и Бейко, Р. Г. (2014).STAMP: статистический анализ таксономических и функциональных профилей. Биоинформатика 30, 3123–3124. doi: 10.1093/биоинформатика/btu494
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Пиромью П., Гритаторн Т., Тимтисонг К., Титтабутр П., Бункерд Н. и Теаумрун Н. (2017). Возможности стерни риса как резервуара инокулята брадиризобиозов в рисово-бобовом севообороте. Заяв. Окружающая среда. микробиол. 83:e01488-17. doi: 10.1128/АЕМ.01488-17
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Родригес, Р. Дж., Уайт, Дж. Ф. мл., Арнольд, А. Э., и Редман, Р. С. (2009). Эндофиты грибов: разнообразие и функциональные роли. Новый фитол. 182, 314–330. doi: 10.1111/j.1469-8137.2009.02773.x
Дж., Уайт, Дж. Ф. мл., Арнольд, А. Э., и Редман, Р. С. (2009). Эндофиты грибов: разнообразие и функциональные роли. Новый фитол. 182, 314–330. doi: 10.1111/j.1469-8137.2009.02773.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Schlegel, M., Munsterkotter, M., Guldener, U., Bruggmann, R., Duo, A., Hainaut, M., et al. (2016). Глобально распространенный корневой эндофит Phialocephala subalpina связывает патогенный и сапрофитный образ жизни. BMC Genomics 17:1015. doi: 10.1186/S12864-016-3369-8
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Schreiter, S., Ding, G.C., Heuer, H., Neumann, G., Sandmann, M., Grosch, R., et al. (2014). Влияние типа почвы на микробиом в ризосфере полевого салата. Фронт. микробиол. 5:144. doi: 10.3389/fmicb.2014.00144
Полнотекстовая перекрестная ссылка | Академия Google
Швагер, Э. (в печати). Обнаружение статистически значимых связей между разреженными и многомерными композиционными данными.
Академия Google
Seppey, C.V.W., Singer, D., Dumack, K., Fournier, B., Belbahri, L., Mitchell, E.A.D., et al. (2017). Характер распространения почвенных микробных эукариот предполагает широкое распространение фаготрофных протистов как альтернативный путь круговорота питательных веществ. Почвенный биол. Биохим. 112, 68–76.
Академия Google
Шах, В., и Субраманиам, С. (2017). Bradyrhizobium japonicum USDA110: репрезентативный модельный организм для изучения воздействия загрязняющих веществ на микробиоту почвы. науч. Общая окружающая среда. 624, 963–967. doi: 10.1016/j.scitotenv.2017.12.185
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Шакья М., Готтель Н., Кастро Х., Ян З.К., Гюнтер Л., Лаббе Дж. и др. (2013). Многофакторный анализ структуры грибных и бактериальных сообществ в корневом микробиоме взрослых деревьев Populus deltoides . PLoS One 8:e76382. doi: 10.1371/journal. pone.0076382
pone.0076382
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Шеннон, П., Markiel, A., Ozier, O., Baliga, N.S., Wang, J.T., Ramage, D., et al. (2003). Cytoscape: программная среда для интегрированных моделей сетей биомолекулярного взаимодействия. Рез. генома. 13, 2498–2504.
Реферат PubMed | Академия Google
Ши, С., Нуччио, Э. Э., Ши, З. Дж., Хе, З., Чжоу, Дж., и Файерстоун, М. К. (2016). Взаимосвязанная ризосфера: в ризосферных сообществах преобладает высокая сложность сети. Экол. лат. 19, 926–936. doi: 10.1111/эл.12630
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Spatafora, J.W., Chang, Y., Benny, G.L., Lazarus, K., Smith, M.E., Berbee, M.L., et al. (2016). Филогенетическая классификация зигомицетов на уровне типов, основанная на данных в масштабе генома. Микология 108, 1028–1046.
Реферат PubMed | Академия Google
ван дер Хейден, М. Г., Мартин, Ф. М., Селоссе, М. А., и Сандерс, И. Р. (2015). Микоризная экология и эволюция: прошлое, настоящее и будущее. Новый фитол. 205, 1406–1423. doi: 10.1111/nph.13288
Г., Мартин, Ф. М., Селоссе, М. А., и Сандерс, И. Р. (2015). Микоризная экология и эволюция: прошлое, настоящее и будущее. Новый фитол. 205, 1406–1423. doi: 10.1111/nph.13288
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
ван Овербек, Л. С., и Сайкконен, К. (2016). Влияние бактериально-грибковых взаимодействий на колонизацию эндосферы. Trends Plant Sci. 21, 230–242. doi: 10.1016/j.tplants.2016.01.003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Vandenkoornhuyse, P., Quaiser, A., Duhamel, M., Le Van, A. и Dufresne, A.(2015). Значение микробиома растительного холобионта. Новый фитол. 206, 1196–1206. doi: 10.1111/nph.13312
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Васкес-Баеза, Ю., Хайд, Э. Р., Суходольский, Дж. С., и Найт, Р. (2016). Воспалительные заболевания кишечника у собак и людей зависят от перекрывающихся, но различных сетей дисбактериоза. Нац. микробиол. 1:16177. doi: 10.1038/nmicrobiol.2016.177
Нац. микробиол. 1:16177. doi: 10.1038/nmicrobiol.2016.177
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Уокер, Дж.Ф., Олдрич-Вулф, Л., Риффель, А., Барбэр, Х., Симпсон, Н.Б., Троубридж, Дж., и соавт. (2011). Разнообразные Helotiales, связанные с корнями трех видов Arctic Ericaceae, не дают никаких доказательств специфичности хозяина. Новый фитол. 191, 515–527. doi: 10.1111/j.1469-8137.2011.03703.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Xiong, W., Jousset, A., Guo, S., Karlsson, I., Zhao, Q., Wu, H., et al. (2017). Сообщества почвенных протистов образуют динамичный центр почвенного микробиома. ISME J. 12, 634–638. doi: 10.1038/ismej.2017.171
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Yang, H., Li, J., Xiao, Y., Gu, Y., Liu, H., Liang, Y., et al. (2017). Комплексное понимание взаимосвязи между почвенным микробным сообществом и бактериальным увяданием табака. Фронт. микробиол. 8:2179. doi: 10.3389/fmicb.2017.02179
Фронт. микробиол. 8:2179. doi: 10.3389/fmicb.2017.02179
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Юргель С. Н., Дуглас Г.М., Комо А.М., Маммолити М., Дюсо А., Персиваль Д. и др. (2017). Изменчивость бактериальных и эукариотических сообществ, связанных с естественными и управляемыми местообитаниями дикой голубики. Фитобиомы 1, 102–113.
Академия Google
Чжан Дж., Коберт К., Флури Т. и Стаматакис А. (2014). PEAR: быстрый и точный метод Illumina Paired-End reAd mergeR. Биоинформатика 30, 614–620. doi: 10.1093/биоинформатика/btt593
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чжан, Р., Виванко, Дж. М., и Шен, К. (2017). Невидимые взаимодействия ризосферы, корня, почвы и микробов для производства сельскохозяйственных культур. Курс. мнение микробиол. 37, 8–14. doi: 10.1016/j.mib.2017.03.008
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Zhang, Y. , Ni, J., Tang, F., Pei, K., Luo, Y., Jiang, L., et al. (2016). Корнеассоциированные грибы Vaccinium carlesii в субтропических лесах Китая: внутри- и межгодовая изменчивость и влияние антропогенных нарушений. науч. Реп. 6:22399. дои: 10.1038/srep22399
, Ni, J., Tang, F., Pei, K., Luo, Y., Jiang, L., et al. (2016). Корнеассоциированные грибы Vaccinium carlesii в субтропических лесах Китая: внутри- и межгодовая изменчивость и влияние антропогенных нарушений. науч. Реп. 6:22399. дои: 10.1038/srep22399
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Зильбер-Розенберг И. и Розенберг Э. (2008). Роль микроорганизмов в эволюции животных и растений: гологеномная теория эволюции. FEMS микробиол. Ред. 32, 723–735. doi: 10.1111/j.1574-6976.2008.00123.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Выращивание черники в домашнем саду
Голубику
можно выращивать на приусадебных участках в любой точке Северной Каролины, если используются правильные виды и соответствующие модификации почвы.Голубика обычно используется в ландшафте в качестве живой изгороди для скрининга, но ее также можно использовать в групповых посадках или в качестве отдельных растений. Голубика – идеальное дополнение к ландшафту круглый год. Весной у них нежные белые или розовые цветы, летние плоды имеют привлекательную небесно-голубую окраску, а осенняя листва добавляет в пейзаж великолепные красные и желтые тона. Кроме того, растения голубики поддаются «органическому» подходу к садоводству, поскольку пестициды редко требуются в посадках домашнего сада.
Голубика – идеальное дополнение к ландшафту круглый год. Весной у них нежные белые или розовые цветы, летние плоды имеют привлекательную небесно-голубую окраску, а осенняя листва добавляет в пейзаж великолепные красные и желтые тона. Кроме того, растения голубики поддаются «органическому» подходу к садоводству, поскольку пестициды редко требуются в посадках домашнего сада.
рН почвы
Голубика требует более низкого pH, чем многие другие мелкие плодовые культуры. Перед посадкой сделайте анализ почвы. Применяйте смачиваемую серу (90% S), если pH выше 5,3 для голубики кроличьей или 5,0 для голубики высокорослой. Используйте 1,0 фунта (2,5 чашки) на 100 квадратных футов на песчаных почвах, чтобы снизить pH на 1 единицу (например, с 6,0 до 5,0). Примените 2,0 фунта на 100 квадратных футов для такого же количества снижения pH на более тяжелых почвах, содержащих ил, глину или более 2% органических веществ.Постарайтесь достичь pH около 4,8; слишком сильное сокращение может нанести ущерб росту куста. Внесите серу как минимум за 3-4 месяца до посадки и перед посадкой сделайте еще один анализ почвы. Если pH все еще выше допустимого диапазона, можно применить дополнительное количество серы. Если вы должны сажать без первоначального теста почвы, смешайте 1 кубический фут торфяного мха с равным количеством песка. На тяжелой глинистой почве или почве, которая иногда остается влажной, на поверхность почвы насыпьте торфяно-песчаную смесь. Если вы уверены, что почва имеет хороший внутренний дренаж, часть торфяно-песчаной смеси можно положить в яму или борозду на несколько сантиметров ниже поверхности почвы.Тем не менее, оставьте достаточно торфяно-песчаной смеси, чтобы сформировать насыпь (одиночное растение) или гребень (ряд растений) на высоте не менее 6 дюймов над поверхностью окружающей почвы (рис. 1). Холм или гряда застрахует от повреждений избытком воды, однако при таком способе посадки обильно поливайте 2–3 раза в неделю в засушливые периоды, потому что поднятая торфо-песчаная смесь быстро высыхает.
Внесите серу как минимум за 3-4 месяца до посадки и перед посадкой сделайте еще один анализ почвы. Если pH все еще выше допустимого диапазона, можно применить дополнительное количество серы. Если вы должны сажать без первоначального теста почвы, смешайте 1 кубический фут торфяного мха с равным количеством песка. На тяжелой глинистой почве или почве, которая иногда остается влажной, на поверхность почвы насыпьте торфяно-песчаную смесь. Если вы уверены, что почва имеет хороший внутренний дренаж, часть торфяно-песчаной смеси можно положить в яму или борозду на несколько сантиметров ниже поверхности почвы.Тем не менее, оставьте достаточно торфяно-песчаной смеси, чтобы сформировать насыпь (одиночное растение) или гребень (ряд растений) на высоте не менее 6 дюймов над поверхностью окружающей почвы (рис. 1). Холм или гряда застрахует от повреждений избытком воды, однако при таком способе посадки обильно поливайте 2–3 раза в неделю в засушливые периоды, потому что поднятая торфо-песчаная смесь быстро высыхает.
Органические добавки
Если почва содержит менее 2% органического вещества (ОВ в отчете об испытаниях почвы), внесение торфяного мха или хорошо разложившихся сосновых опилок или коры улучшит выживаемость и рост растений.Нанесите от 3 до 4 дюймов органического материала поверх ряда полосой шириной от 18 до 24 дюймов и тщательно заделайте с помощью ротационной фрезы или лопаты на глубину от 6 до 8 дюймов. Подготовка грядок осенью позволит провести посадку в начале сезона (с конца февраля до конца марта, в зависимости от местоположения). Если органический материал вносят осенью, можно одновременно добавить любую серу, необходимую для снижения pH. Избегайте открытия борозды, добавления органического материала и посадки непосредственно в чистый органический материал.Управление водой и питательными веществами, вероятно, будет затруднено в чистом органическом материале, и растения с большей вероятностью станут слабыми и погибнут.
Дренаж
Растения голубики требуют отличного дренажа почвы, поэтому перед посадкой необходимо обеспечить дренаж.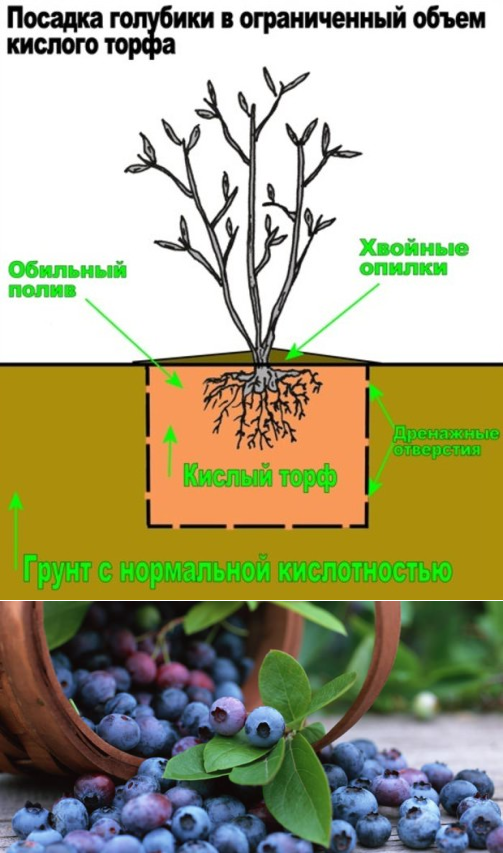 Почвенные карты или наблюдения за почвенным профилем могут помочь в прогнозировании внутреннего дренажа. В качестве альтернативы, выкапывание «сухого колодца» может быть очень эффективным средством определения дренажа почвы. Выкопайте ямы глубиной от 6 до 8 дюймов и наблюдайте за уровнем воды после проливных дождей.Вода не должна оставаться в яме более 24 часов, в противном случае выберите другое место или посадите на грядах, достаточно высоких, чтобы уровень воды достигал 6-8 дюймов в глубину в течение 24 часов.
Почвенные карты или наблюдения за почвенным профилем могут помочь в прогнозировании внутреннего дренажа. В качестве альтернативы, выкапывание «сухого колодца» может быть очень эффективным средством определения дренажа почвы. Выкопайте ямы глубиной от 6 до 8 дюймов и наблюдайте за уровнем воды после проливных дождей.Вода не должна оставаться в яме более 24 часов, в противном случае выберите другое место или посадите на грядах, достаточно высоких, чтобы уровень воды достигал 6-8 дюймов в глубину в течение 24 часов.
Орошение
В большинстве сезонов и на большинстве почв полив абсолютно необходим в год посадки. Ручной полив из шланга возможен для нескольких кустов, однако шланг с замачиванием обычно дает более равномерное смачивание. На больших насаждениях системы с использованием микроразбрызгивателей оказались более успешными, чем капельницы с точечным источником.Даже 2 капельницы на растение часто недостаточно увлажняют почву в корневой зоне. Не менее 50% площади под капельной линией должно быть увлажнено. Система орошения должна быть рассчитана на более высокую производительность микроразбрызгивателей (около 10 галлонов в час) по сравнению с 1 или 2 галлонами в час для капельниц. Выровняйте микроразбрызгиватели, чтобы избежать переувлажнения почвы вокруг кроны кустов. Использование автоматических таймеров в системах капельного орошения или микроразбрызгивания может привести к поверхностной корневой системе и загниванию корней, если системы подают воду ежедневно.Применяйте полив не чаще одного раза в два дня, чтобы снизить вероятность заражения корневой гнилью.
Система орошения должна быть рассчитана на более высокую производительность микроразбрызгивателей (около 10 галлонов в час) по сравнению с 1 или 2 галлонами в час для капельниц. Выровняйте микроразбрызгиватели, чтобы избежать переувлажнения почвы вокруг кроны кустов. Использование автоматических таймеров в системах капельного орошения или микроразбрызгивания может привести к поверхностной корневой системе и загниванию корней, если системы подают воду ежедневно.Применяйте полив не чаще одного раза в два дня, чтобы снизить вероятность заражения корневой гнилью.
Солнце против тени
Желателен полный солнечный свет, но обычно приемлема тень до 50%. Однако урожай снижается с увеличением тени, поэтому сажайте в солнечном месте, чтобы получить максимальный урожай.
Какие виды
На Прибрежной равнине и в Пьемонте можно выращивать как высокорослую ( Vaccinium corymbosum ), так и кроличью ( V. ashei ) голубику. Тем не менее, только высокие кусты могут постоянно выдерживать минимальные зимние температуры ниже 10 ° F, которые регулярно наблюдаются в горах. Кроличий глаз более засухо- и жаростойкий и выдерживает более широкий спектр типов почв, чем высокий кустарник. По этим причинам кроличий глаз легче привить и успешно выращивать в Пьемонте и на более сухих почвах Прибрежной равнины, чем высокорослый. Совсем недавно была выпущена группа сортов, называемых южными высокорослыми. Эти сорта занимают промежуточное положение между высокорослым и кроличьим глазом по почвенной и климатической адаптации.
Разновидности
Высокорослые сорта начинают созревать в середине мая на юго-востоке Прибрежной равнины и в начале июля в горах. Разновидности кроличьего глаза появляются в середине июня на юго-востоке Прибрежной равнины. Необходимо посадить более одного сорта кроличьего глаза, чтобы обеспечить перекрестное опыление, необходимое для получения максимальных урожаев. Ниже приведены сорта в порядке созревания от раннего к позднему, которые успешно выращиваются и рекомендуются домовладельцам:
Прибрежная равнина — Хайбуш: O’Neal (южный высокий куст), Morrow, Reveille, Croatan, Murphy, Bounty, Blue Ridge (южный высокий куст), ‘ Bluechip, ‘Джерси’
Прибрежная равнина и Пьемонт — Rabbiteye: ‘Climax’, ‘Premier’, ‘Tifblue’, ‘Powderblue’, ‘Centurion’ Highbush: ‘Blue Ridge’ (южный высокорослый кустарник) и ‘O’Neal’ ( южный высокорослый) также успешно выращивались на почвах Пьемонта. «Наследие» (высокий южный) достоин испытания и в этих регионах.
«Наследие» (высокий южный) достоин испытания и в этих регионах.
Горы и Верхний Пьемонт — Хайбуш: «Герцог», «Санрайз», «Блюрей», «Блюкроп», «Торо», «Беркли», «Джерси»
Посадки
а) Растения — 2- или 3-летние питомники высотой 12-36 дюймов хорошо пересаживаются. Корни должны быть постоянно влажными между выкапыванием и пересадкой.
b) Время — Поздняя зима (февраль-март), как только почва может быть обработана, лучше всего подходит для растений с открытыми корнями; Осенняя (ноябрь-декабрь) посадка была успешной на песчаной почве на юго-востоке Прибрежной равнины с растениями с открытой корневой системой и в других районах с растениями в горшках.
c) Расстояние между рядами – Высаживайте высококустарниковые сорта через каждые 4-5 футов в ряду и 8-10 футов между рядами. Сажайте сорта кроличьих глаз через каждые 6 футов в ряду и 10-12 футов между рядами.
d) Глубина — Высаживайте на ту же глубину, на которой растения росли в питомнике, если на поверхность будет наноситься органическая мульча. При посадке без мульчи сажайте на 1-2 дюйма глубже, чтобы почва осела, уплотните почву вокруг растения ногами и тщательно полейте.
При посадке без мульчи сажайте на 1-2 дюйма глубже, чтобы почва осела, уплотните почву вокруг растения ногами и тщательно полейте.
e) Обрезать – Обрезать примерно 2 ⁄ 3 верхушечных побегов на растениях с голой корневой системой и 1 ⁄ 2 на растениях в горшках, оставив только 1-3 наиболее сильных прямостоячих побега.Удалите все оставшиеся цветочные бутоны (пухлые округлые бутоны), чтобы растения не цвели в первый год.
Внесение удобрений
a) Используйте осторожность — черника легко повреждается избытком удобрений. Внесите рекомендуемое количество из отчета об испытаниях почвы и дайте дождю 4 дюйма или эквивалентному количеству полива между применениями.
b) Первый год – не вносить удобрения сразу после посадки. Подождите, пока первые листья не достигнут полного размера, затем внесите 1 столовую ложку специального удобрения для азалии, 12-12-12 или 10-10-10 по кругу на расстоянии 1 фута от растений. Повторяйте внесение удобрений с 6-недельными интервалами в зависимости от количества осадков или орошения до середины августа на Прибрежной равнине и середины июля в горах. Используйте 1/2 ст.л. аммиачной селитры вместо комплексного удобрения для второго и последующих внесений, если содержание фосфора в пробе почвы было выше 60.
c) Второй год — удвоить нормы первого года, но увеличить окружность растений до 1 1 ⁄ 2 футов. Примените первое приложение, когда новый рост начинается весной.
d) Плодоносящие растения. Весной, когда начинается рост, внесите 1 стакан полного удобрения, такого как 10-10-10, в круг на расстоянии 3 фута от растения. Если желателен более сильный рост, подкормите 1 ⁄ 4 чашкой аммиачной селитры с интервалом в 6 недель. На зрелых кустах 6-12 дюймов нового роста достаточно для оптимального баланса размера растений и урожайности. Дополнительный рост необходимо обрезать. Это может привести к потере продукции, но необходимо не допустить, чтобы растения стали слишком большими. Определите потребность в подкормке, исходя из количества прироста побегов.
Определите потребность в подкормке, исходя из количества прироста побегов.
e) Понижение рН — если рН почвы несколько выше в укоренившейся посадке на основании анализа почвы; затем внесите сульфат аммония, а не нитрат аммония. Если pH на 0,5 единицы или более выше допустимого диапазона, внесите смачиваемую серу узкой полосой под капельную линию куста из расчета 0,1 фунта на куст, чтобы снизить pH на 1 единицу.
Мульчирование
Органический материал, такой как кора, древесная щепа, опилки или сосновая солома, в качестве мульчи толщиной от 3 до 4 дюймов на поверхности после посадки обеспечивает более однородную влажность почвы, снижает температуру почвы и в целом способствует лучшему росту и выживанию кустов.Сосновая кора, щепа или опилки имеют рН от 3,5 до 4,5 и более желательны, чем те же мульчи из лиственных пород с соответствующим рН выше 5,0. Тем не менее, мульча из твердой древесины на поверхности была удовлетворительной. Избегайте липких древесных опилок, которые могут запечатать. кровати и предотвращения проникновения воды.
кровати и предотвращения проникновения воды.
Борьба с сорняками
а) Мульчирование. Мульчирование посадок черники в домашних условиях является лучшей формой борьбы с сорняками. Если мульча применяется после посадки и заменяется со скоростью 1 дюйм в год, проблем с сорняками не должно возникнуть.Вручную вырывайте или рыхлите случайный рост сорняков. Если середина ряда находится в дерне, косите часто, чтобы уменьшить проникновение побегов травы и семян сорняков в мульчированную область.
b) Без мульчирования. Избегайте глубокой обработки, так как корни черники находятся очень близко к поверхности. Мотыга не более чем на 1 дюйм в глубину. Кроме того, часто (раз в 2 недели) рыхлите, когда сорняки прорастают, чтобы уменьшить конкуренцию с ростом куста и предотвратить нарушение корней, которое может произойти при удалении крупных сорняков.
c) Гербициды. Есть некоторые химические гербициды, которые домовладельцы могут использовать для борьбы с сорняками. Пожалуйста, свяжитесь с вашим агентом по распространению знаний в округе для получения актуальных рекомендаций.
Пожалуйста, свяжитесь с вашим агентом по распространению знаний в округе для получения актуальных рекомендаций.
Обрезка
а) Высокорослый — Если после посадки растения сильно обрезать, как это рекомендовано, на второй год потребуется небольшая обрезка, за исключением удаления всех цветочных почек и любых слабых, поврежденных или больных побегов. Используйте аналогичную стратегию обрезки на третий год, за исключением того, что на сильных побегах можно оставить несколько цветочных почек. На четвертый год куст должен быть 4-5 футов высотой и способным обрабатывать урожай, но тщательно прореживать цветочные почки, чтобы предотвратить переплодоношение и сильное постоянное сгибание молодых побегов под тяжестью плодов.Когда кусты созреют, удалите старые слабые, больные или поврежденные побеги; обрезайте высокие сильные побеги, чтобы усилить ветвление на более низком уровне и контролировать высоту куста; и тонкие плодоносящие побеги, чтобы уменьшить количество цветочных почек примерно на 50%. Обрезка в период покоя. Поздняя зима наиболее желательна, особенно в горах.
Обрезка в период покоя. Поздняя зима наиболее желательна, особенно в горах.
б) Кроличий глаз — В течение первых 3 лет обрезка очень похожа на обрезку высокорослого кустарника; однако чрезмерно высокие и гибкие побеги необходимо обрезать, чтобы стимулировать ветвление и укрепить побег.Со зрелыми кустами, которые чрезмерно сильнорослы, несмотря на низкие нормы внесения удобрений, обрезка слишком сильнорослых побегов в конце июля поможет контролировать высоту куста и повысить урожайность. Зимняя обрезка зрелых кустов также аналогична рекомендации для высококустарников, за исключением того, что детальное прореживание плодоносящих побегов на каждом побеге менее критично, и потребуется удаление большего количества отпрысков (побегов, развивающихся на расстоянии от кроны).
Урожай
a) Урожайность. При хорошем уходе взрослые кусты высококустарника и кроличьего глаза должны давать более 10 фунтов ежегодно.Разновидности кроличьего глаза иногда могут давать до 25 фунтов с растения.
b) Защита птиц. Птицы любят собирать чернику. Они могут потреблять весь урожай с небольшой посадки. Пластиковая или тканевая сетка, накинутая на кусты или поддерживаемая каркасом во время созревания плодов, является единственным практическим средством контроля.
c) Периодичность – голубика высокорослая будет лучшего качества, если ее собирать каждые 5-7 дней в зависимости от температуры. Вкус кроличьего глаза улучшается, если ягоды собирать реже; примерно каждые 10 дней позволяет получить максимальный вкус с небольшим количеством мягких перезревших фруктов.
Потенциал органического производства
Голубику часто можно успешно выращивать без инсектицидов и фунгицидов за пределами коммерческих производственных площадей на юго-востоке Северной Каролины. Японские жуки иногда могут повредить плоды во время созревания, но листва довольно устойчива. Восприимчивые растения, такие как розы или виноград, обычно удаляют листвой до того, как на чернике появятся повреждения. Низкие нормы внесения удобрений делают органические источники жизнеспособной альтернативой.Конский навоз оказался подходящим источником азота, а каменный фосфат обеспечивает достаточное количество фосфата. С сорняками можно бороться поверхностной культивацией или, что более желательно, мульчей.
Низкие нормы внесения удобрений делают органические источники жизнеспособной альтернативой.Конский навоз оказался подходящим источником азота, а каменный фосфат обеспечивает достаточное количество фосфата. С сорняками можно бороться поверхностной культивацией или, что более желательно, мульчей.
Источники растений
Голубика размножается вегетативно черенками. Как лиственные (зимние), так и хвойные (летние) черенки можно укоренить в тумане без использования гормонов укоренения. Хотя это может сделать любитель на заднем дворе или местный питомник, лучшим источником однородных растений для создания новой посадки являются питомники, специализирующиеся на размножении голубики.Некоторые коммерческие источники будут продавать отдельные растения, в то время как другие требуют минимальный заказ от 50 до 100 растений. Частичный список питомников приведен ниже.
Питомник Finch Blueberry
ПО Ящик 669
Бейли, Северная Каролина 27807
(252) 235-4664
(Кроличий глаз, южный высокорослый, высокорослый)
Эд Дарден
106 Йеллоу Кат Роуд
Роуз Хилл, Северная Каролина 28458
(910) 289-2849
(южный высокорослый, высокорослый заячий глаз)
Атлантическая черничная компания
475 с. Чу-роуд
Чу-роуд
Хаммонтон, Нью-Джерси 08037
(609) 561-8600
(высокий для гор)
NC Foundation Seed Production
ПО Ящик 33245, Методическая станция
Роли, Северная Каролина 27606
(919) 737-2821
(Последние выпуски NC)
Питомник AG Ammon
ПО Ящик 488
Чатсуорт, Нью-Джерси 08019
(609) 726-1370
(высокий для гор)
Детская с видом на башню
70912 CR 388
Саут-Хейвен, Мичиган 49090
(616) 637-1279
(высокий для гор)
Ферма и питомник Fall Creek, Inc.
39318 Джаспер-Лоуэлл Роуд
Лоуэлл, Орегон 97452
(541) 937 2973
(Высокорослый, южный высокорослый)
Для дальнейшего чтения
- Культура черники, Rutgers University Press, New Brunswick, NJ
- Blueberry Diseases in Michigan, MSU Ag Facts Extension Bulletin No. E1731
- Blueberry Science, Rutgers University Press, New Brunswick, NJ
- Борьба с вредителями черники, Кооперативное расширение Северной Каролины AG-492
- Коммерческое производство черники во Флориде, паб Университета Флориды.
№ SP179
- Сборник болезней черники и клюквы. APS Press, Сент-Пол, MN
- Болезни и членистоногие вредители голубики. Бюллетень Службы сельскохозяйственных исследований Северной Каролины 468
- Руководство по производству голубики высокорослой, NRAES-55, Итака, Нью-Йорк
- Маленькие фрукты в домашнем саду. Гоф, Р.Э. И Э.Б. Полинг (ред.). Food Products Press, Бингемтон, Нью-Йорк.
- Борьба с вредителями и культура мелких плодовых культур, Бюллетень кооперативной службы распространения знаний Университета Джорджии No.102
Рис. 1. Растение голубики в торфяно-песчаной смеси.
Дата публикации: 30 ноября 2002 г.
Лучшая почвенная смесь для новых растений высокорослой голубики?
У меня есть клиент, который хочет, чтобы я превратил его левую лужайку в грядку размером примерно 41 х 6 футов прямо напротив его дома.Насколько я могу судить, он получит там по крайней мере 8 часов солнца.
Единственное, что нужно посадить, это 4-6 ягод черники. Почва в нашем районе в основном глинистая, и в одной части этой области у задней части грядки могут быть корни.
Итак, я не буду обрабатывать всю площадь ротационной обработкой, потому что она просто снова уплотнится в следующий раз, когда пойдет дождь, и я не буду убирать всю почву со всей грядки и заменять ее новой почвой. Я буду опрыскивать участок Раундапом за 8-10 дней до начала, затем скашиваю мертвую траву до высоты 1 дюйм, затем разгребаю участок, затем выкапываю широкие ямы в местах размещения растений, затем убираю глинистой почвы и замените ее землей в мешках, так как мне не понадобится достаточно, чтобы оправдать доставку почвы навалом. Затем будет посажена черника и замульчирована новая грядка.
Затем будет посажена черника и замульчирована новая грядка.
На прошлой неделе я использовал мешки с почвой в домах двух клиентов для посадки растений. Первая почва, которую я купил, пришла из Home Depot, и это была органическая садовая почва Vigoro. Это был отличный материал. У него была куполообразная грубость, и он совсем не уплотнялся, но это была в основном органическая почва.
Второй грунт, который я купил, был у Лоуза. Это был их конкурирующий бренд под названием Sta-Green почва для посадки деревьев и кустарников. Почва для деревьев/кустарников Miracle Grow довольно хороша, но у них ее не было, поэтому я предположил, что это будет хорошо.Это было не… Это было около 10 мелкой органической почвы, 10% песка, 80% измельченной древесной щепы! Это выглядело как прошлогодняя частично разложившаяся мульча. В основном это была древесная щепа. Мне пришлось смешать его с верхним слоем почвы, который я ранее использовал, чтобы поднять низину на участке этого клиента, а затем я заменил одолженный верхний слой почвы глиной, которую выкопал, сажая новые растения.
Так что избегайте древесно-кустарниковой почвы Sta-Green в Лоусе!
В любом случае, я хотел бы использовать почву Vigoro Garden для посадки черники, но я не знаю тел.Кроме того, я считаю, что в идеале его следует смешивать с родной почвой, но наша родная почва ужасна, поэтому я не использую для смесей.
Должен ли я использовать 100% садовую почву Vigoro или смешать ее с верхним слоем почвы в мешках (если я смогу найти приличный верхний слой почвы в мешках) или что-то еще, чтобы посадить эти 4-6 новых ягод черники? Я хочу обеспечить им хороший старт и хороший тел.
В 2004 году я посадил у себя дома 7, но они мало выросли, потом 2 погибли. Они были довольно здоровы из года в год, давали много ягод, но мало росли, хотя 4 были в земле и 3 в горшках 16-18 дюймов.Жаркая погода и засуха у нас бывают почти каждый год, так что поливать надо, а в прошлом году полив был ограничен.
Спасибо….
Листья голубики на заднем дворе могут рассказать историю дефицита почвы и проблем с pH
Помимо того, что голубика является самой ценной плодовой культурой в Грузии, она также является одним из самых популярных плодовых растений среди садоводов.
Их довольно легко выращивать, учитывая правильные почвенные условия, и у них очень мало проблем с насекомыми или болезнями растений по сравнению с другими фруктами.Когда проблемы действительно возникают, виновниками обычно являются дефицит минералов или проблемы с pH.
Голубика очень хорошо приспособлена к Джорджии, потому что она хорошо растет на кислых почвах с рН от 4,5 до 5,2. Чтобы убедиться, что у вас правильный рН почвы и низкий уровень кальция в почве, перед посадкой проведите тест почвы. В некоторых приусадебных участках pH почвы и уровень кальция могут быть очень высокими, что делает почву непригодной для выращивания голубики. Высокий уровень pH и кальция в почве часто вызван чрезмерным внесением органических добавок или известняком (карбонатом кальция), которые необходимы для выращивания большинства овощей, газонов и ландшафтных кустарников.Исключение составляют черника и некоторые другие кислотолюбивые растения. Известняк никогда не следует наносить вокруг кислолюбивых растений. Кислотолюбивые растения, такие как черника, азалии, рододендроны, гардении и камелии, должны быть отделены от других растений в вашем ландшафте или саду, чтобы избежать конфликтов рН почвы.
Кислотолюбивые растения, такие как черника, азалии, рододендроны, гардении и камелии, должны быть отделены от других растений в вашем ландшафте или саду, чтобы избежать конфликтов рН почвы.
Когда клиент звонит по поводу желтых листьев на чернике, это почти всегда связано с дефицитом питательных веществ. В частности, если и молодые листья, и зрелые листья одинаково желтые, чаще всего это дефицит азота.
Дефицит железа также может вызвать пожелтение самых молодых листьев или новых побегов черники. Жилки листьев останутся темно-зелеными и будут выделяться на желтом фоне листьев с дефицитом железа. Дефицит железа часто возникает, когда pH выше 5,3 или когда уровень кальция или фосфора в почве слишком высок. Если рН почвы выше 5,3, рекомендуется использовать серу для снижения рН почвы. Растения, орошаемые водой из глубоких колодцев в известняковых породах, могут испытывать временный дефицит железа в засушливые периоды, когда они выживают исключительно за счет щелочной воды.
Дефицит магния иногда наблюдается в Грузии, и обычно это происходит на старых листьях. На молодых растениях голубики кроличьего глаза наиболее распространенным признаком дефицита магния являются зрелые листья, которые розовые по краям и желтоватые между жилками. При низком уровне магния, согласно анализу почвы, вы можете добавить соли Эпсома (сульфат магния) из расчета 3 унции на растение, чтобы компенсировать дефицит. Если уровень кальция в почве слишком высок, это также усугубит дефицит магния.
Мы часто сталкиваемся с ситуацией, когда чернику и другие кислолюбивые растения сажают слишком близко к фундаменту дома, тротуару или подъездной дорожке. Бетонные и другие каменные работы могут выщелачивать известняк и кальций в окружающую почву и повышать рН почвы слишком высоко для этих типов растений. В этих ситуациях лучшим вариантом будет отодвинуть голубику от каменной конструкции.
Когда дело доходит до выбора сортов голубики для приусадебных участков, лучшим выбором будет голубика кроличья глазка. Голубика кроличьего глаза родом из Джорджии и хорошо растет во всех частях штата. Важно посадить более одного куста, чтобы произошло перекрестное опыление. При покупке растений обязательно выбирайте сорта, рекомендованные для Грузии. Список рекомендуемых сортов кроличьего глаза приведен в циркуляре UGA Extension 946 «Черника для домашнего сада», который можно найти в Интернете по адресу extension.uga.edu/publications/detail.cfm?number=C946.
Голубика кроличьего глаза родом из Джорджии и хорошо растет во всех частях штата. Важно посадить более одного куста, чтобы произошло перекрестное опыление. При покупке растений обязательно выбирайте сорта, рекомендованные для Грузии. Список рекомендуемых сортов кроличьего глаза приведен в циркуляре UGA Extension 946 «Черника для домашнего сада», который можно найти в Интернете по адресу extension.uga.edu/publications/detail.cfm?number=C946.
Сезон черники в Грузии с середины апреля (юг Джорджии) до конца июля (север Джорджии).При хорошем уходе кусты голубики дадут плоды на второй или третий год после пересадки. К шестому году они дадут до 2 галлонов с растения. Урожайность будет увеличиваться в течение нескольких лет по мере роста растений.
Пол Пульезе — агент по сельскому хозяйству и природным ресурсам в отделении по развитию Университета Джорджии в округе Бартоу.
Комбинация полезных бактерий улучшает урожай черники и качество почвы — Ю — 2020 — Пищевая наука и питание
1 ВВЕДЕНИЕ
Blueberry вызывает большой интерес во всем мире благодаря своей высокой питательной ценности, богатому вкусу и полезным для здоровья свойствам. В результате того, что потребители хорошо получают здоровую пищу, мировое производство голубики быстро увеличилось за последние десятилетия. С развитием экономики и заботой о здоровье людей производство голубики в Китае быстро превратилось из небольшой отрасли в лидера в Азиатско-Тихоокеанском регионе всего за несколько лет. В 2016 г. посевная площадь голубики в Китае составляла более 20 % от общей мировой площади, и на ней производилось около 20 000 тонн свежей голубики (Brazelton & Young, 2014).Тем не менее, рост производства голубики все еще отстает от потребительского спроса (Виллата, 2012). Поэтому оптимизация условий выращивания голубики и повышение урожайности голубики имеют большое значение для общества и экономики.
Большинство потребителей положительно относятся к органическим продуктам питания, и рыночные перспективы здоровых органических продуктов весьма оптимистичны (Kihlberg & Risvik, 2007). В частности, потребители, которые заинтересованы в покупке голубики как полезного для здоровья фрукта, часто готовы платить за добавочную стоимость органической голубики как продукта «с пониженным риском» (Drummond, Smagula, Annis, & Yarborough, 2009). Помимо пользы для безопасности пищевых продуктов, система органического земледелия позволяет сформировать благоприятный цикл, основанный на здоровой экологической среде, путем улучшения биоразнообразия, почвенной среды и защиты окружающей среды. Например, инсектициды широкого спектра действия эффективны в борьбе с сельскохозяйственными вредителями. Однако они также угрожают жизни и размножению естественных врагов и серьезно угрожают сельскохозяйственной экологической среде. Напротив, продукты, одобренные для использования в органическом сельском хозяйстве, совместимы с полезными насекомыми, которые, в свою очередь, способствуют естественной биологической борьбе с вредителями (Roubos, Rodriguez-Saona, Holdcraft, Mason, & Isaacs, 2014).Более того, по сравнению с другими культурами голубика обладает уникальными преимуществами в плане органического выращивания из-за ее относительно высокой силы роста и устойчивости к вредителям из-за короткой истории одомашнивания, насчитывающей менее 100 лет (Sciarappa et al.
Помимо пользы для безопасности пищевых продуктов, система органического земледелия позволяет сформировать благоприятный цикл, основанный на здоровой экологической среде, путем улучшения биоразнообразия, почвенной среды и защиты окружающей среды. Например, инсектициды широкого спектра действия эффективны в борьбе с сельскохозяйственными вредителями. Однако они также угрожают жизни и размножению естественных врагов и серьезно угрожают сельскохозяйственной экологической среде. Напротив, продукты, одобренные для использования в органическом сельском хозяйстве, совместимы с полезными насекомыми, которые, в свою очередь, способствуют естественной биологической борьбе с вредителями (Roubos, Rodriguez-Saona, Holdcraft, Mason, & Isaacs, 2014).Более того, по сравнению с другими культурами голубика обладает уникальными преимуществами в плане органического выращивания из-за ее относительно высокой силы роста и устойчивости к вредителям из-за короткой истории одомашнивания, насчитывающей менее 100 лет (Sciarappa et al. , 2008).
, 2008).
Хотя производство органической голубики стало важной частью индустрии голубики во всем мире, в большинстве регионов производство органической голубики по-прежнему сталкивается со многими проблемами, такими как увеличение производственных затрат или ресурсов (особенно при удобрении и борьбе с сорняками органическим способом), ограниченный выбор. методов борьбы с болезнями или вредителями, а также низкое производство органической черники (Pretty, 1997).Полезный микроб, часто известный как ризобактерия, стимулирующая рост растений (PGPR), считается одним из решений этих проблем. PGPR участвуют во многих физиологических процессах растений, включая установление морфологии растений, рост растений, круговорот питательных веществ и защиту от болезней (Wu, Cao, Li, Cheung, & Wong, 2005). Сообщалось, что некоторые из PGPR вызывают системную устойчивость растений как к патогенам, так и к насекомым, стимулируя пути SA и JA/ET (Niu et al., 2011).В другом исследовании применение двух штаммов Bacillus , OSU-142 и M3, показало положительный эффект на рост и урожайность малины (Orhan, Esitken, Ercisli, Turan, & Sahin, 2006). Помимо благотворного воздействия на растения, PGPR также может изменять свойства почвы в долгосрочной перспективе. Секреции B. cereus AR156 способны влиять на корневые секреты растений (Zhou et al., 2016). Изменение корневых секретов влияет на рост растений; кроме того, он обеспечивает почву большим количеством органических веществ, таких как молочная и капроновая кислоты (Wang et al., 2019 г.). Также было показано, что PGPR могут способствовать удержанию влаги в почве (Zheng et al., 2018). Тем не менее, информации о влиянии PGPR на рост, урожайность и питательные вещества почвы в органической системе посадки все еще недостаточно.
В этом исследовании мы оценили влияние отдельных и комплексных полезных микробов на рост, урожайность, качество плодов голубики, а также содержание почвы после одного сезона посадки в системе органического выращивания путем анализа основных соответствующих параметров.
2 МАТЕРИАЛЫ И МЕТОДЫ
2.
 1 Получение консорциума бактерий
1 Получение консорциума бактерийBacillus amyloliquefaciens JC65, B. subtilis 7ze3, B. subtilis JC03 и B. licheniforims HS10 выращивали при 28°C в среде LB в течение 24 часов. Четыре бактериальные культуры затем доводили водой до ~ 5 × 10 7 КОЕ/мл. Разведенную культуру бактерий смешивали в соотношении 1:1:1 в М1 (JC65 + 7ze3 + JC03), М2 (JC65 + 7ze3 + HS10) и М3 (JC65 + JC03 + HS10).
2.2 Полевой эксперимент
Полевые испытания начались в декабре 2016 года и продлятся 2 года. Экспериментальный участок расположен в аграрно-экологическом парке Ланьмэй, деревня Куйчжан, город Нанкин (118° 22′ 51,67′′ восточной долготы, 31° 56′ 12,14′′ северной широты). Сорт голубики, использованный в этом испытании, — Lanmei No.1, выбранный компанией Zhejiang Lanmei Agriculture Co., Ltd. Саженцы голубики были пересажены в 2016 году.
В этом исследовании было проведено пять обработок, в том числе контрольная обработка С для органической системы без добавления полезных микробов; обработка S, для органической системы, дополненной отдельными полезными бактериями B. amyloliquefaciens JC65; обработка M1, M2 и M3 для органических систем, дополненных смешанными полезными бактериями JC65 + 7ze3 + JC03, JC65 + 7ze3 + HS10 и JC65 + JC03 + HS10 соответственно. Мы использовали JC65 в качестве основного штамма в формуле, потому что, во-первых, ранее сообщалось, что JC65 оказывает значительное стимулирующее действие на устойчивость арбуза к Acidovorax avenae subsp. citrulli , а также на рост растений (Jiang et al., 2015). Цель этого плана эксперимента состояла в том, чтобы выявить более эффективные консорциумы в стимулировании органического роста голубики с использованием полезного микроорганизма JC65 в качестве основного штамма с двумя другими альтернативными изолятами Bacillus из окружающей среды.Применимость смесей из трех штаммов была проанализирована путем проверки различий между эффектами отдельных бактерий и различных консорциумов на производство черники. Кроме того, мы также хотели обобщить предварительные правила смешения бактерий, чтобы направлять развитие других консорциумов бактерий, сравнивая эффекты различных консорциумов из трех штаммов.
amyloliquefaciens JC65; обработка M1, M2 и M3 для органических систем, дополненных смешанными полезными бактериями JC65 + 7ze3 + JC03, JC65 + 7ze3 + HS10 и JC65 + JC03 + HS10 соответственно. Мы использовали JC65 в качестве основного штамма в формуле, потому что, во-первых, ранее сообщалось, что JC65 оказывает значительное стимулирующее действие на устойчивость арбуза к Acidovorax avenae subsp. citrulli , а также на рост растений (Jiang et al., 2015). Цель этого плана эксперимента состояла в том, чтобы выявить более эффективные консорциумы в стимулировании органического роста голубики с использованием полезного микроорганизма JC65 в качестве основного штамма с двумя другими альтернативными изолятами Bacillus из окружающей среды.Применимость смесей из трех штаммов была проанализирована путем проверки различий между эффектами отдельных бактерий и различных консорциумов на производство черники. Кроме того, мы также хотели обобщить предварительные правила смешения бактерий, чтобы направлять развитие других консорциумов бактерий, сравнивая эффекты различных консорциумов из трех штаммов.
В 2016 г. для эксперимента было выбрано хорошо проветриваемое поле с рыхлой почвой, высоким содержанием органических веществ и отсутствием накопления влаги.На выбранное поле вносили по одной тонне на гектар серы и органического компоста из торфа, щепы, гнили и сосновой корки. Почву накрывают черной пленкой для поддержания температуры и влажности почвы. Сухая солома была помещена в борозды в качестве покровной культуры, чтобы помочь контролировать рост травы. Голубика была посажена на холмики с расстоянием 1,5 м, а расстояние между растениями каждой ягоды голубики составляло 1,2 м. На гектар было посажено около 3750 саженцев. На одну обработку закладывали один холмик поля с 30 саженцами.Каждую обработку повторяли 3 раза на холмиках, случайно распределенных по всему полю. В феврале 2017 г. и феврале 2018 г. в поле вносилось органическое удобрение, состоящее в основном из овечьего навоза, в количестве 7 500 кг/га. Капельное орошение использовалось в каждой системе для контроля влажности почвы и предотвращения чрезмерной влажности, приводящей к болезням. Ручная прополка одинаково проводилась во всех протестированных органических системах. Кисло-сладкая жидкость (сахар: уксус: вино: сок: чистая вода = 1.5:1:1:1:5) применяли вблизи фруктового сада для отлова взрослых мух и майских жуков в период созревания и сбора урожая (с конца мая по июль 2018 г.). Разбавленный 0,6%-й водный раствор матрина опрыскивали 600 мл/га для борьбы с вредителями, такими как мухи. Плоды голубики собирали вручную. Чтобы сохранить сильные побеги и оптимизировать качество плодов, а не максимизировать урожай, деревья обрезали зимой.
Ручная прополка одинаково проводилась во всех протестированных органических системах. Кисло-сладкая жидкость (сахар: уксус: вино: сок: чистая вода = 1.5:1:1:1:5) применяли вблизи фруктового сада для отлова взрослых мух и майских жуков в период созревания и сбора урожая (с конца мая по июль 2018 г.). Разбавленный 0,6%-й водный раствор матрина опрыскивали 600 мл/га для борьбы с вредителями, такими как мухи. Плоды голубики собирали вручную. Чтобы сохранить сильные побеги и оптимизировать качество плодов, а не максимизировать урожай, деревья обрезали зимой.
2.3 Определение индекса роста
В каждой обработке случайным образом отбирали 24 растения из трех повторяющихся курганов.Высоту растений измеряли рулеткой. Содержание хлорофилла в листьях определяли с помощью измерителя хлорофилла (TYS-A) компании Zhejiang Top Yunnong Technology Co., Ltd. Чистую скорость фотосинтеза листьев 9 случайно выбранных деревьев черники для каждой обработки определяли с помощью фотосинтеза LI-COR Li-6400.![]() аппарат.
аппарат.
2.4 Отбор проб почвы и определение
Образцы почвы были взяты до обработки (декабрь 2016 г.) и после сбора урожая (август 2018 г.).Пробы почвы отбирали пятиточечным методом на одной и той же глубине отбора проб около 10–15 см под землей. Корни растений и мелкие камни были удалены, а почва высушена на воздухе. После измельчения аммонийный азот (AN), доступный фосфор (AP) и доступный калий (AK) определяли почвенным тестером (типа TPY-6A), а значение pH почвы измеряли pH-метром (Ray -Магнитный типа ПХС-3С). Значения ЕС почвы определяли с помощью измерителя проводимости (Bante 950).Процентное содержание органического вещества (ОМ) в почве определяли с помощью окислительно-восстановительного титрования бихромата калия с подогревом на масляной бане (Schollenberger, 1931).
2.5 Определение качества плодов
Для каждой обработки отбирали и сжимали 15 плодов голубики одинакового размера и твердости. Сок тщательно перемешивали и 3 раза отбирали пробы для определения растворимых сахаров на сахариметре ЛБ32Т и растворимых сухих веществ на рефрактометре ATAGO PAL-1.Один грамм мякоти плодов отбирали и измельчали из пяти плодов одинакового размера и твердости при каждой обработке. Витамин С определяли с помощью ультрафиолетовой спектрофотометрии (Santos, Lima, Março, & Valderrama, 2016). Для определения содержания растворимого белка использовали метод окрашивания кумасси бриллиантовым синим G-250 (Jones, Hare, & Compton, 1989). Содержание титруемой кислоты определяли титрованием фенолфталеином (Alamo, Maquieira, Puchades, & Sagrado, 1993). Четырнадцать плодов одинаковой зрелости лиофилизировали и растирали в жидком азоте.Было собрано два грамма измельченного материала для определения общего содержания антоцианов (Соломахин и Бланке, 2010). Анализы повторяли трижды.
Сок тщательно перемешивали и 3 раза отбирали пробы для определения растворимых сахаров на сахариметре ЛБ32Т и растворимых сухих веществ на рефрактометре ATAGO PAL-1.Один грамм мякоти плодов отбирали и измельчали из пяти плодов одинакового размера и твердости при каждой обработке. Витамин С определяли с помощью ультрафиолетовой спектрофотометрии (Santos, Lima, Março, & Valderrama, 2016). Для определения содержания растворимого белка использовали метод окрашивания кумасси бриллиантовым синим G-250 (Jones, Hare, & Compton, 1989). Содержание титруемой кислоты определяли титрованием фенолфталеином (Alamo, Maquieira, Puchades, & Sagrado, 1993). Четырнадцать плодов одинаковой зрелости лиофилизировали и растирали в жидком азоте.Было собрано два грамма измельченного материала для определения общего содержания антоцианов (Соломахин и Бланке, 2010). Анализы повторяли трижды.
2.6 Статистический анализ
Данные были проанализированы с использованием программного обеспечения для статистического анализа (SAS Institute). Был использован однофакторный дисперсионный анализ (ANOVA). Средние значения были разделены с использованием теста наименьших значимых различий (LSD).
Был использован однофакторный дисперсионный анализ (ANOVA). Средние значения были разделены с использованием теста наименьших значимых различий (LSD).
3 РЕЗУЛЬТАТА
3.1 Влияние PGPR на рост и урожайность голубики
Через тридцать дней после обработки измеряли индекс роста голубики, содержание хлорофилла и чистую скорость фотосинтеза листьев голубики. По сравнению с контрольным органическим культивированием C обработка композитными бактериями (M1, M2, M3) увеличивала содержание хлорофилла в листьях черники на 15,33%, 21,50% и 9,47% соответственно. Не было существенной разницы в содержании хлорофилла между одной бактериальной обработкой S и контрольной C.Более того, обработки M1, M2 и M3 увеличили среднюю чистую скорость фотосинтеза листьев голубики на 11,79%, 13,21% и 9,65% соответственно по сравнению с контролем C. Однако из-за существенной изменчивости листьев при обработке между обработками не было обнаружено существенной разницы в скорости чистого фотосинтеза (таблица 1). Через 69 дней после обработки также регистрировали индекс роста черники и содержание хлорофилла в листьях. По сравнению с контролем обработка композитными бактериями (М1, М2, М3) увеличивала содержание хлорофилла в листьях черники на 1.47%, 3,03% и 2,49% соответственно. Кроме того, M1, M2 и M3 увеличили среднюю высоту голубики по сравнению с контролем C на 2,40%, 2,72% и 2,62% соответственно, но без существенной разницы между обработками (таблица 1).
Через 69 дней после обработки также регистрировали индекс роста черники и содержание хлорофилла в листьях. По сравнению с контролем обработка композитными бактериями (М1, М2, М3) увеличивала содержание хлорофилла в листьях черники на 1.47%, 3,03% и 2,49% соответственно. Кроме того, M1, M2 и M3 увеличили среднюю высоту голубики по сравнению с контролем C на 2,40%, 2,72% и 2,62% соответственно, но без существенной разницы между обработками (таблица 1).
| Лечение | 0 дней после обработки | Через 30 дней после лечения | Через 69 дней после лечения | |||
|---|---|---|---|---|---|---|
| Высота растения (см) | Высота растения (см) | Хлорофилл (СПАД) | Чистая скорость фотосинтеза (мкмоль CO 2 м −2 с −1 ) | Высота растения (см) | Хлорофилл (СПАД) | |
| С | 92. 00 ± 0,75 А 00 ± 0,75 А | 93,25 ± 0,96 А | 34,32 ± 0,33D | 6,300 ± 0,466 А | 93,83 ± 0,48 А | 57,05 ± 0,16 до н.э. |
| С | 92.00 ± 0,71 А | 93,75 ± 1,15 А | 35,20 ± 0,51D | 6,225 ± 0,326 А | 94,58 ± 0,77 А | 57,02 ± 0,7°С |
| М1 | 92. 00 ± 0,81 А 00 ± 0,81 А | 94,13 ± 0,52 А | 39,58 ± 0,62В | 7,043 ± 0,644 А | 96,08 ± 1,16 А | 57,89 ± 0,32ABC |
| М2 | 92.17 ± 0,95 А | 93,79 ± 0,82 А | 41,70 ± 0,27 А | 7,132 ± 0,558 А | 96,38 ± 1,68 А | 58,78 ± 0,27 А |
| М3 | 92. 00 ± 0,73 А 00 ± 0,73 А | 93,88 ± 0,65 А | 37,57 ± 0,57°С | 6,908 ± 0,523 А | 96,29 ± 1,17 А | 58,47 ± 0,20AB |
Примечание
- Данные представлены как среднее ± стандартное отклонение.Значения с разными заглавными буквами значительно различаются при разных обработках: p < 0,01. C: пустой контроль; С: JC65; M1: JC65 + 7ze3 + JC03; M2: JC65 + HS10 + 7ze3; M3: JC65 + JC03 + HS10.
Общий урожай голубики также рассчитывался после сбора урожая. Сорта М1, М2 и М3 повысили урожайность голубики на 3,45%, 14,56% и 6,78% по сравнению с контролем С соответственно.Урожайность голубики, обработанной М2, значительно выше, чем при других обработках. Однако однократная бактериальная обработка S не показала значительного повышения урожайности по сравнению с контролем. Между всеми вариантами обработки не было выявлено существенной разницы в весе одного плода (рис. 2).
Сорта М1, М2 и М3 повысили урожайность голубики на 3,45%, 14,56% и 6,78% по сравнению с контролем С соответственно.Урожайность голубики, обработанной М2, значительно выше, чем при других обработках. Однако однократная бактериальная обработка S не показала значительного повышения урожайности по сравнению с контролем. Между всеми вариантами обработки не было выявлено существенной разницы в весе одного плода (рис. 2).
3.2 Влияние PGPR на качество плодов голубики
Также определяли качество плодов черники, включая содержание растворимого сахара, титруемой кислоты, витамина С, растворимого твердого вещества, растворимого белка и антоцианов.Результаты показали, что по сравнению с контролем C обработка составными бактериями M1, M2 и M3 значительно улучшает качество плодов черники. Среди всех обработка М2 показала наилучшее влияние на качество плодов с увеличением содержания растворимого сахара, витамина С, растворимых сухих веществ и растворимого белка на 4,21%, 17,31%, 2,41% и 21,65% соответственно (рис. 2). Кроме того, при обработке М2 количество титруемой кислоты уменьшилось на 10,81% (рис. 2). Среднее содержание антоцианов при обработке М2 также составляло 5.на 99% выше, чем в контроле. Обработка одним штаммом S также повысила качество плодов черники на 1,03 % по среднему содержанию растворимого сахара и на 5,88 % по среднему содержанию растворимого белка (рис. 2). Однако это увеличение не было статистически значимым.
2). Кроме того, при обработке М2 количество титруемой кислоты уменьшилось на 10,81% (рис. 2). Среднее содержание антоцианов при обработке М2 также составляло 5.на 99% выше, чем в контроле. Обработка одним штаммом S также повысила качество плодов черники на 1,03 % по среднему содержанию растворимого сахара и на 5,88 % по среднему содержанию растворимого белка (рис. 2). Однако это увеличение не было статистически значимым.
3.3 Влияние PGPR на качество почвы
Мы собрали образцы почвы до и после сбора урожая и определили основные физические и химические свойства почвы. Свойства почвы изменились после одного сезона посадки в органической системе, которая использовалась в данном исследовании в качестве контроля.Содержание аммонийного азота в почве снизилось на 20,64 % в контроле, тогда как в варианте М2 было обнаружено увеличение на 3,77 % (рис. 3). Органическое вещество почвы уменьшилось на 6,17% в контрольной органической системе ко времени уборки; напротив, содержание органического вещества в почве значительно увеличилось при обработке М1, М2 и М3 после посадки на 2,07%, 2,79% и 2,04% соответственно (рис. 3). Что касается содержания доступного калия и фосфора, хотя оно и уменьшилось во всех обработках, скорость снижения при обработке M2 была значительно ниже, чем при других обработках.При однократной бактериальной обработке S скорость снижения содержания органического вещества в почве была значительно ниже, чем при контрольной обработке; однако никаких других существенных различий в физических и химических свойствах почвы при этой обработке не было обнаружено по сравнению с контрольной обработкой C (таблица 2). Значение EC почвы снизилось при сборе урожая при обработке C, в то время как при обработке сложными бактериями, особенно в M2 и M3, падение было более значительным.
3). Что касается содержания доступного калия и фосфора, хотя оно и уменьшилось во всех обработках, скорость снижения при обработке M2 была значительно ниже, чем при других обработках.При однократной бактериальной обработке S скорость снижения содержания органического вещества в почве была значительно ниже, чем при контрольной обработке; однако никаких других существенных различий в физических и химических свойствах почвы при этой обработке не было обнаружено по сравнению с контрольной обработкой C (таблица 2). Значение EC почвы снизилось при сборе урожая при обработке C, в то время как при обработке сложными бактериями, особенно в M2 и M3, падение было более значительным.
| Лечение | рН | EC (мкСм·см −1 ) | АН (‰) | АК (‰) | АП (‰) | ОМ (%) | |
|---|---|---|---|---|---|---|---|
| С | До лечения | 6. 38 ± 0,01а 38 ± 0,01а | 355,00 ± 14.11а | 26,61 ± 0,59аб | 140,40 ± 1,40аб | 39,97 ± 0,19а | 2,14 ± 0,02а |
| После обработки | 5.58 ± 0,01b | 324,00 ± 14,11b | 18,27 ± 0,37e | 129,73 ± 2,91d | 28,97 ± 0,82d | 2,01 ± 0,02с | |
| С | До лечения | 6. | 373,33 ± 29,74а | 25,84 ± 0,53б | 141,50 ± 2,31а | 40,03 ± 0,09а | 1,99 ± 0,07с |
| После обработки | 5.58 ± 0,02b | 315,67 ± 10,69б | 20,50 ± 0,40d | 129,50 ± 6,84d | 34,97 ± 0,19c | 1,99 ± 0,02с | |
| М1 | До лечения | 6. 38 ± 0,02а 38 ± 0,02а | 358,00 ± 16,70а | 26,27 ± 0,87б | 141,23 ± 2,71а | 39,95 ± 0,43а | 2,00 ± 0,06с |
| После обработки | 5.58 ± 0,02b | 283,67 ± 8,50c | 24,61 ± 0,79с | 135,57 ± 3,39 до н.э. | 35,12 ± 0,14с | 2,05 ± 0,02 до н.э. | |
| М2 | До лечения | 6. 38 ± 0,01а 38 ± 0,01а | 365,67 ± 19,14а | 26,55 ± 0,52аб | 140,23 ± 0,96аб | 40,06 ± 0,16а | 2,03 ± 0,05 до н.э. |
| После обработки | 5.58 ± 0,01b | 263,67 ± 10,60с | 27,55 ± 0,96а | 140,23 ± 2,80аб | 37,29 ± 1,07б | 2,09 ± 0,02аб | |
| М3 | До лечения | 6. 37 ± 0,01а 37 ± 0,01а | 369,00 ± 27,22а | 26,54 ± 0,56аб | 139,23 ± 1,21аб | 39,96 ± 0,45а | 2,03 ± 0,04 до н.э. |
| После обработки | 5.57 ± 0,01б | 271,33 ± 14,98с | 26,54 ± 0,44аб | 133,23 ± 3,83 кд | 35,56 ± 0,77с | 2,07 ± 0,01б | |
Примечание
- Данные представлены как среднее ± стандартное отклонение.
 Значения с разными строчными буквами значительно различаются при разных обработках: p < 0,05. C: пустой контроль; С: JC65; M1: JC65 + 7ze3 + JC03; M2: JC65 + HS10 + 7ze3; M3: JC65 + JC03 + HS10.
Значения с разными строчными буквами значительно различаются при разных обработках: p < 0,05. C: пустой контроль; С: JC65; M1: JC65 + 7ze3 + JC03; M2: JC65 + HS10 + 7ze3; M3: JC65 + JC03 + HS10. - Сокращения: АК, доступный калий; АН, аммонийный азот; AP, доступный фосфор; ОМ, органическое вещество.
4 ОБСУЖДЕНИЕ
Давно признано, что успешный симбиоз растений и микробов, таких как бобовые растения и ризобии, благотворно влияет на здоровье и рост растений в различных аспектах.В случае голубики высокорослой ( Vaccinium corymbosum L.) эрикоидные микоризы спонтанно колонизируют корни голубики и образуют взаимовыгодные симбиотические отношения (Smith & Read, 2008). Эрикоидные микоризы способствуют росту растений, расщепляя органические питательные вещества почвы и доставляя их микоризным растениям (Read, Leake, & Langdale, 1989), например, продуцируя кислую внеклеточную протеазу для расщепления белков почвы на доступные источники азота черники (Bajwa & Read , 1985 г. ).Однако мало что известно о влиянии PGPR на посадки голубики. Было показано, что PGPR оказывают благотворное влияние на растения, контролируя болезни растений либо косвенно подавляя патогены, либо индуцируя системную устойчивость растений, помогая улучшить качество почвы или напрямую стимулируя рост растений, активируя изменения в профилях экспрессии генов, связанных с ростом растений (Bhattacharyya & Джа, 2012). Были сообщения о том, что PGPR могут быть применимыми агентами против болезней растений при выращивании черники.При целенаправленной доставке медоносной пчелой B. subtilis эффективно борется с болезнью мумие ягод путем подавления роста возбудителя Monilinia vaccinii — corymbosi (Dedej, Delaplane, & Scherm, 2004; Scherm, Ngugi, Savelle, & Edwards , 2004 г.). В нашем исследовании мы сравнили рост и производство голубики в системе органического земледелия с различными видами обработки бактериями или без них. Мы обнаружили, что добавление полезных бактерий в органическую систему выращивания голубики способствует росту растений голубики и значительно увеличивает урожайность голубики, особенно при обработке M2 (7ze3 + JC65 + HS10), в которой 14.
).Однако мало что известно о влиянии PGPR на посадки голубики. Было показано, что PGPR оказывают благотворное влияние на растения, контролируя болезни растений либо косвенно подавляя патогены, либо индуцируя системную устойчивость растений, помогая улучшить качество почвы или напрямую стимулируя рост растений, активируя изменения в профилях экспрессии генов, связанных с ростом растений (Bhattacharyya & Джа, 2012). Были сообщения о том, что PGPR могут быть применимыми агентами против болезней растений при выращивании черники.При целенаправленной доставке медоносной пчелой B. subtilis эффективно борется с болезнью мумие ягод путем подавления роста возбудителя Monilinia vaccinii — corymbosi (Dedej, Delaplane, & Scherm, 2004; Scherm, Ngugi, Savelle, & Edwards , 2004 г.). В нашем исследовании мы сравнили рост и производство голубики в системе органического земледелия с различными видами обработки бактериями или без них. Мы обнаружили, что добавление полезных бактерий в органическую систему выращивания голубики способствует росту растений голубики и значительно увеличивает урожайность голубики, особенно при обработке M2 (7ze3 + JC65 + HS10), в которой 14. Урожайность черники увеличилась на 56 % (рис. 1). Jha и Subramanian (2018) сообщили, что накопление растворимых сахаров в растениях негативно регулирует фотосинтез растений и биосинтез сахаров, в то время как инокуляция полезными микроорганизмами увеличивает накопление растворимых сахаров в растениях за счет усиления фотосинтеза. Точно так же мы обнаружили, что содержание хлорофилла в листьях при обработке М2 было значительно выше, чем при контрольной обработке (таблица 1). Кроме того, средняя чистая скорость фотосинтеза при обработке M2 также составляла 13.на 21 % выше, чем в контроле (таблица 1). Эти результаты свидетельствуют о том, что полезные бактерии, особенно бактериальный консорциум M2, обладают способностью индуцировать фотосинтез и, следовательно, приводят к более высоким индексам роста и урожайности. Улучшенный рост и урожайность согласуются с предыдущим отчетом о том, что B. amyloliquefaciens JC65 (прежнее название 54) способен стимулировать рост арбуза (Jiang et al.
Урожайность черники увеличилась на 56 % (рис. 1). Jha и Subramanian (2018) сообщили, что накопление растворимых сахаров в растениях негативно регулирует фотосинтез растений и биосинтез сахаров, в то время как инокуляция полезными микроорганизмами увеличивает накопление растворимых сахаров в растениях за счет усиления фотосинтеза. Точно так же мы обнаружили, что содержание хлорофилла в листьях при обработке М2 было значительно выше, чем при контрольной обработке (таблица 1). Кроме того, средняя чистая скорость фотосинтеза при обработке M2 также составляла 13.на 21 % выше, чем в контроле (таблица 1). Эти результаты свидетельствуют о том, что полезные бактерии, особенно бактериальный консорциум M2, обладают способностью индуцировать фотосинтез и, следовательно, приводят к более высоким индексам роста и урожайности. Улучшенный рост и урожайность согласуются с предыдущим отчетом о том, что B. amyloliquefaciens JC65 (прежнее название 54) способен стимулировать рост арбуза (Jiang et al. , 2015). Тем не менее, стимулирующий эффект JC65 на рост в этом исследовании составляет 2,72%, что намного ниже, чем общий показатель стимулирования белка, составляющий 110%, о котором сообщается для арбуза.Это может быть связано с ограниченным экспериментальным периодом по сравнению с циклом роста многолетнего древесного растения. В качестве альтернативы, кислые условия почвы, необходимые для удовлетворительного роста голубики (Harmer, 1945), также могут влиять на рост и стимулирующее рост растений действие бактерий. В будущем скрининг на наличие PGPR, совместимых с кислой почвой, станет потенциальным направлением для повышения эффективности использования PGPR в производстве голубики.
Урожайность голубики (серые столбцы) и масса одного плода (связанные диаграммы рассеяния) при различных обработках.C: пустой контроль; С: JC65; M1: JC65 + 7ze3 + JC03; M2: JC65 + HS10 + 7ze3; M3: JC65 + JC03 + HS10. Существенные различия отмечены как: «**» для p < 0,01
Плод черники – это не только вкусный фрукт, но и полезная пища. Было доказано, что его богатое разнообразие веществ, таких как полифенольные соединения, особенно антоцианы, полисахариды и тритерпеноиды, полезно для здоровья во многих аспектах. Антоцианы, как сильные антиоксиданты и противовоспалительные средства для клеток млекопитающих (Bornsek et al., 2012; Krikorian et al., 2010), показано, что они способны обратить вспять процесс нейронного и поведенческого старения (Joseph et al., 1999), ингибировать пролиферацию и инвазию раковых клеток (Faria et al., 2010), предотвращать ожирение, другие нарушения метаболического синдрома (Norberto et al., 2013) и т. д. Наши результаты показывают, что добавление Bacillus способствует среднему содержанию антоцианов в плодах черники с максимальным увеличением на 5,99% при лечении M2 (рис. 2). Помимо различий между сортами голубики, на содержание антоцианов в голубике влияют многие факторы, включая свет, pH, влажность, внесение удобрений, географическое положение и время отбора проб в процессе посадки (Akerström, Forsum, Rumpunen, & Jäderlund, 2009; Akerström, Jaakola, Bång, & Jäderlund, 2010; Rieger, Müller, Guttenberger, & Bucar, 2008).
Было доказано, что его богатое разнообразие веществ, таких как полифенольные соединения, особенно антоцианы, полисахариды и тритерпеноиды, полезно для здоровья во многих аспектах. Антоцианы, как сильные антиоксиданты и противовоспалительные средства для клеток млекопитающих (Bornsek et al., 2012; Krikorian et al., 2010), показано, что они способны обратить вспять процесс нейронного и поведенческого старения (Joseph et al., 1999), ингибировать пролиферацию и инвазию раковых клеток (Faria et al., 2010), предотвращать ожирение, другие нарушения метаболического синдрома (Norberto et al., 2013) и т. д. Наши результаты показывают, что добавление Bacillus способствует среднему содержанию антоцианов в плодах черники с максимальным увеличением на 5,99% при лечении M2 (рис. 2). Помимо различий между сортами голубики, на содержание антоцианов в голубике влияют многие факторы, включая свет, pH, влажность, внесение удобрений, географическое положение и время отбора проб в процессе посадки (Akerström, Forsum, Rumpunen, & Jäderlund, 2009; Akerström, Jaakola, Bång, & Jäderlund, 2010; Rieger, Müller, Guttenberger, & Bucar, 2008). Интересно, что сообщалось, что применение регулятора защиты растений, такого как метилжасмонат, положительно влияет на содержание антоцианов в голубике, однако ценой потери урожая (Percival & MacKenzie, 2007). Многочисленные исследования показывают, что некоторые бактерии из Bacillus sp. способны вызывать системную устойчивость растений (Niu et al., 2011) путем высвобождения индуцирующих устойчивость соединений, таких как внеклеточные полисахариды (Jiang, Fan, Xie, & Guo, 2016) и липопептиды (Ongena et al., 2007 г.). Приведенные выше отчеты предлагают возможное объяснение того, что повышение содержания антоцианов, достигнутое в органической системе посадки, дополненной одной или смешанной Bacillus , может быть, по крайней мере, частично вызвано защитой растений, индуцированной полезными бактериями.
Интересно, что сообщалось, что применение регулятора защиты растений, такого как метилжасмонат, положительно влияет на содержание антоцианов в голубике, однако ценой потери урожая (Percival & MacKenzie, 2007). Многочисленные исследования показывают, что некоторые бактерии из Bacillus sp. способны вызывать системную устойчивость растений (Niu et al., 2011) путем высвобождения индуцирующих устойчивость соединений, таких как внеклеточные полисахариды (Jiang, Fan, Xie, & Guo, 2016) и липопептиды (Ongena et al., 2007 г.). Приведенные выше отчеты предлагают возможное объяснение того, что повышение содержания антоцианов, достигнутое в органической системе посадки, дополненной одной или смешанной Bacillus , может быть, по крайней мере, частично вызвано защитой растений, индуцированной полезными бактериями.
Содержание растворимых сахаров (%), содержание титруемой кислоты (%), содержание витамина С (мг/100 г), содержание растворимых сухих веществ (%), содержание растворимого белка (%) и содержание антоцианов (мг/г) черники при различных лечения. C: пустой контроль; С: JC65; M1: JC65 + 7ze3 + JC03; M2: JC65 + HS10 + 7ze3; M3: JC65 + JC03 + HS10. Существенные различия отмечены как: «*» для p < 0,05, «**» для p < 0,01
C: пустой контроль; С: JC65; M1: JC65 + 7ze3 + JC03; M2: JC65 + HS10 + 7ze3; M3: JC65 + JC03 + HS10. Существенные различия отмечены как: «*» для p < 0,05, «**» для p < 0,01
Плодовый индекс также важен для качества голубики. Дополнительные бактерии при обработке М2 увеличили содержание растворимого сахара в плодах черники на 4,21%, содержание витамина С на 17,31%, содержание растворимых сухих веществ на 2,41% и содержание растворимого белка на 21%.65%, тогда как титруемая кислота во фруктах снизилась на 10,81% (рис. 2). Эти результаты согласуются с предыдущим отчетом, в котором применение микробного консорциума улучшило качество плодов перца (Yu et al., 2019). Также сообщалось, что полезные микроорганизмы способны увеличивать накопление растворимого сахара в растениях за счет усиления фотосинтеза (Jha & Subramanian, 2018). Примечательно, что показано, что BBP3-1, полисахарид черники, ингибирует прогрессирование опухоли и обладает иммуномодулирующим действием (Sun, Liu, Wu, Feng, & Meng, 2015).Таким образом, улучшение растворимого сахара не только улучшает фруктовый вкус, но также может способствовать улучшению здоровья черники.
Качество почвы оказывает долгосрочное влияние на рост сельскохозяйственных культур. Растения, выращиваемые на органических фермах, часто страдают от недостатка питательных веществ в почве, поскольку в органических системах ограничено добавление химических удобрений (Kitchen, McDonald, Shepherd, Lorimer, & Graham, 2003). Понимание динамики качества почвы важно для выявления состояния питательных веществ сельскохозяйственных культур и оценки устойчивости отдельных систем земледелия в сельскохозяйственной практике.Азот, фосфор и калий обычно считаются тремя наиболее важными питательными веществами для растений. Также было обнаружено, что удобрение NPK оказывает положительное влияние на урожай черники (Starast, Karp, Vool, Paal, & Albert, 2007). В этом исследовании мы сравнили изменения питательных веществ в почве после одного сезона посадки в органической системе посадки, мотивированной одной бактерией JC65 (S), микробным консорциумом JC65 + 7ze3 + JC03 (M1), JC65 + 7ze3 + HS10 (M2) и JC65 + JC03 + HS10 (M3) с контрольной органической системой посадки (C) (таблица 2).Снижение содержания питательных веществ в почве после одного сезона посадки было значительно меньше в органической системе посадки, мотивированной полезными микробами, по сравнению с контрольной органической системой посадки (Рисунок 3), что указывает на эффект сохранения питательных веществ в почве полезными микробами. Эти результаты подтверждаются сообщениями о способности обитающей в почве Bacillus увеличивать доступное в почве питание азотом, фосфором и калием. Ван, Лю и Ли (2014) показали, что в кислых почвенных условиях Bacillus увеличивает содержание доступного фосфора, превращая нерастворимый фосфор в растворимые ионы.Точно так же, как сообщили Sheng and He (2006), растворение калийсодержащих минералов увеличилось после инокуляции Bacillus , что привело к улучшению доступности почвенного калия для растений. Кроме того, также сообщалось о фиксации почвенного азота Bacillus (Lucas García, Probanza, Ramos, Colón Flores, & Gutiérrez, 2004). Хотя комбинация Bacillus в этом исследовании повлияла на показатели питательных веществ в почве, она не изменила pH почвы (таблица 2).Эта особенность способствует применению консорциума бактерий при органическом выращивании голубики с особыми требованиями к pH почвы (Harmer, 1945). Несколько исследований показали влияние Bacillus на растения в кислых условиях. Результаты этого исследования показывают, что как отдельные консорциумы B. amyloliquefaciens JC65, так и Bacillus в этом исследовании способны функционировать в кислых почвах и оказывать благотворное воздействие на растения и почву.
Скорость изменения почвенных показателей при различных обработках после одного сезона органического выращивания голубики.C: пустой контроль; С: JC65; M1: JC65 + 7ze3 + JC03; M2: JC65 + HS10 + 7ze3; M3: JC65 + JC03 + HS10. АН, аммонийный азот; АК, доступный калий; AP, доступный фосфор; ОВ, органическое вещество
Еще одним важным показателем плодородия почвы является содержание органического вещества. Хейнс увеличил урожай черники, применяя почвенные кондиционеры, такие как торф и сосновая кора, которые значительно увеличивают содержание органического вещества в почве (Haynes & Swift, 1986). Фарук, Заман, Шуманн, Мадани и Персиваль (2012) также показали, что при посадке голубики в почву со значительной пространственной изменчивостью урожайность голубики положительно коррелирует с органическим веществом почвы на конкретном участке.Наши результаты показали, что добавление Bacillus положительно влияет на увеличение содержания органического вещества в почве (рис. 3). Таким образом, повышение урожайности голубики можно объяснить повышенным содержанием органического вещества в почве в органических системах посадки, мотивированных полезными микроорганизмами (S/M1/M2/M3). В частности, Ван и соавт. (2019) сообщили, что B. cereus AR156 может индуцировать секрецию органических кислот, включая молочную кислоту и капроновую кислоту, из корней томата, тем самым способствуя росту и метаболизму обитающих в корнях микроорганизмов.Он предложил важный метод, который бактерии используют для повышения своей жизнеспособности в бесплодной почве, одновременно способствуя развитию органического вещества почвы. Кроме того, засоление почвы, часто вызванное чрезмерным использованием химических удобрений, приводит к риску повреждения солями, когда засоление почвы превышает порог солеустойчивости растения. Значение EC почвы было снижено после обработки бактериями, что указывает на эффективное действие микробного агента на предотвращение засоления почвы (таблица 2). PGPR были разработаны как одна из стратегий снижения токсического эффекта, вызванного высокой соленостью.Помимо индуцирования системной толерантности растений к солевому стрессу, PGPR способны стимулировать рост растений, облегчая поглощение растениями питательных веществ (Kohler, Caravaca, Carrasco, & Roldan, 2006), что, возможно, может привести к снижению значения EC почвы в этом исследовании.
По сравнению с обработкой одной бактерией, органическая система посадки, дополненная комплексом из трех бактерий JC03 + JC65 + HS10, показала более высокую эффективность в повышении урожайности черники (рис. 1), питательных веществ качества плодов (рис. 2) и поддержании питательных веществ в почве (рис. 3). ).Превосходство составных микробов может быть обусловлено просто аддитивным эффектом, синергетической активностью или тем и другим. Чтобы лучше использовать ресурсы окружающей среды и получить преимущество в конкуренции, микробы дифференцировались в уникальные системы разложения материала и по-разному действовали в борьбе с болезнями (Yu et al., 2017). Таким образом, аддитивный эффект теоретически целесообразно достигать путем смешивания бактерий с разными функциями. Кроме того, бактерии широко взаимодействуют друг с другом в обширном сообществе, таком как почвенная среда.Система кворум-сенсора с циклом распознавания, реагирования на эндогенные и экзогенные внеклеточные сигналы, а также секреции собственных сигналов является универсальным механизмом, используемым бактериями и тем самым создающим взаимодействия и регулирование различных судеб и действий клеток (Cloud-Hansen et al., 2006). Например, было доказано, что образование биопленки имеет решающее значение для успешной колонизации и эффективности биологического контроля B. subtilis (Chen et al., 2013). Образование биопленки B.subtilis может стимулироваться лактозой, которая регулируется системой определения кворума (Duanis-Assaf, Steinberg, Chai, & Shemesh, 2016). Кроме того, микробный пептидогликан и фрагменты клеточной стенки могут действовать как важная сигнальная молекула, приносящая пользу другим бактериям (Cloud-Hansen et al., 2006). B. cereus и его очищенный пептидогликан могут способствовать росту популяции других бактерий, поскольку они используются в качестве источника углерода для роста (Peterson, Dunn, Klimowicz, & Handelsman, 2006).Помимо универсального механизма взаимодействия, Bacillus обладает уникальным взаимодействием внутри рода. Было показано, что среди испытанных штаммов большинство бактерий, способных способствовать образованию биопленки B. subtilis посредством межвидового взаимодействия, относятся к собственному роду Bacillus (Shank et al., 2011). Вместе составные микробные агенты в обработках M1/M2/M3 в этом исследовании могут действовать не только в добавочном веществе; вместо этого комбинация Bacillus может демонстрировать синергетический эффект за счет комплексных межвидовых взаимодействий.Кажется многообещающим, что соединение микробов является потенциальным средством для эффективного стимулирования роста, предотвращения болезней и улучшения почвы в практике органического земледелия.
5 ВЫВОДЫ
На основании полученных результатов мы пришли к выводу, что добавление полезных микробов в органическое производство голубики значительно способствует росту растений и улучшает качество плодов голубики. Интересно, что при сочетании различных полезных микроорганизмов стимулирующий эффект на производство голубики значительно усиливался, что указывает на синергетическую активность среди конкретной смеси бактерий.Также показана способность полезного микроба удерживать почву, особенно для увеличения органического вещества почвы. Изменение питательных веществ в почве может быть одной из причин того, что добавление бактерий влияет на рост и качество черники. Дальнейшие исследования должны быть сосредоточены на поиске более эффективного бактериального консорциума и изучении взаимодействий между смешанными видами, вызывающими эту синергетическую активность.
БЛАГОДАРНОСТИ
Эта работа финансировалась Нанкинским научно-техническим проектом (201716066), Китайским фондом постдокторских наук (2019M651863), Инновационными технологиями современной сельскохозяйственной промышленности в провинции Цзянсу (CX(19)2008) и Национальным фондом естественных наук Китая (31672075). ).
КОНФЛИКТ ИНТЕРЕСОВ
Все авторы заявляют об отсутствии конфликта интересов.
ЭТИЧЕСКОЕ УТВЕРЖДЕНИЕ
В этом исследовании не использовались люди или позвоночные животные.
.